题目内容
1.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3(s)+3H2(g)$\stackrel{高温}{?}$W(s)+3H2O(g)(1)上述反应的化学平衡常数表达式为K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)?W(s)+2H2O (g)△H=+66.0kJ?mol-1
WO2(g)+2H2(g)?W(s)+2H2O (g)△H=-137.9kJ?mol-1
则WO2(s)?WO2(g),则WO2(s)?WO2 (g) 的△H=+203.9 kJ•mol-1.
分析 (1)根据化学平衡常数概念:生成物浓度幂之积与反应物浓度幂之积之比可得,注意固体纯液体不写入;
(2)由反应方程式知,消耗的H2与生成的水的物质的量相等,假定H2与水蒸气的物质的量分别为2mol、3mol,再根据转化率=$\frac{物质的转化量}{物质的起始量}×100%$计算;
(3)由表中主要成分与温度关系可知,第一阶段反应为WO3与H2反应是W2O5,同时还生成H2O,配平书写方程式;
580℃时,温度介于550℃~600℃,固体为W2O5、WO2的混合物;
根据三个阶段的方程式进行计算三个阶段消耗H2物质的量之比;
(4)已知:①WO2(s)+2H2(g)═W(s)+2H2O (g)△H=+66.0kJ•mol-1
②WO2(g)+2H2(g)═W(s)+2H2O (g)△H=-137.9kJ•mol-1
根据盖斯定律,①-②可得.
解答 解:(1)反应WO3(s)+3H2(g)$\stackrel{高温}{?}$W(s)+3H2O(g),K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$,故答案为:K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$;
(2)由反应方程式知,消耗的H2与生成的水的物质的量相等,故H2的平衡转化率为$\frac{3mol}{2mol+3mol}×100%$=60%;
故答案为:60%;
(3)由表中主要成分与温度关系可知,第一阶段反应为WO3与H2反应是W2O5,同时还生成H2O,反应方程式为2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O,580℃时,温度介于550℃~600℃,固体为W2O5、WO2的混合物;
假定有2molWO3,由2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O、W2O5+H2$\frac{\underline{\;高温\;}}{\;}$2WO2+H2O、WO2+2H2$\frac{\underline{\;高温\;}}{\;}$W+2H2O,三个阶段消耗的氢气的物质的量之比为1mol:1mol:2mol×2=1:1:4,
故答案为:2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O;1:1:4;
(4)已知:①WO2 (s)+2H2 (g)?W (s)+2H2O (g);△H1=+66.0kJ•mol-1
②WO2 (g)+2H2?W (s)+2H2O (g);△H2=-137.9kJ•mol-1
根据盖斯定律,①-②得WO2(s)?WO2 (g),故该反应的△H=△H1-△H2=+203.9kJ•mol-1;
故答案为:+203.9kJ•mol-1.
点评 本题考查化学平衡常数的书写、化学平衡移动原理、化学平衡计算、盖斯定律等,题目选择的素材比较陌生,注意△H有符号,以考查学生的能力为主,难度中等.

 ”和“
”和“ ”分别表示不同的原子.下列对此反应的分类一定不正确的是( )
”分别表示不同的原子.下列对此反应的分类一定不正确的是( )
| A. | 化合反应 | B. | 可逆反应 | C. | 置换反应 | D. | 氧化还原反应 |
| A. | 同主族元素形成的单质熔沸点自上而下逐渐升高 | |
| B. | 核外电子排布相同的微粒化学性质一定相同 | |
| C. | 同主族元素最高价含氧酸的酸性随核电荷数的增加而减弱 | |
| D. | 非金属元素的气态氢化物的稳定性越强其沸点就越高 |
①氢解反应:COS(g)+H2(g)?H2S(g)+CO(g)△H1=+7KJ•mol-1
②水解反应:COS(g)+H2O(g)?H2S(g)+CO2(g)△H2
已知反应中相关的化学键键能数据如下:
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| E/(KJ•mol-1) | 803 | 742 | 577 | 339 | 465 |
(1)在以上脱除COS的反应中,若某反应有1mol电子发生转移,则该反应吸收的热量为3.5KJ.
(2)已知热化学方程式CO(g)+H2O(g)?H2(g)+CO2(g)△H3 则△H3=-42KJ•mol-1.
(3)氢解反应平衡后增大容器的体积,则正反应速率减小,COS的转化率不变(填“增大”或“减小”或“不变”).
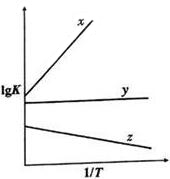
(4)COS氢解反应的平衡常数K与温度T具有如下的关系式lgK=$\frac{a}{T}$+b,式中a和b均为常数.
①如图中,表示COS氢解反应的直线为z,判断依据为氢解反应为吸热反应,升高温度,k增大.
②一定条件下,催化剂A和B对COS的氢解均具有催化作用,相关数据如下表所示:
| 达到平衡所需的时间/min | a的数值 | b的数值 | |
| 催化剂A | t | a1 | b1 |
| 催化剂B | 2t | a2 | b2 |
③某温度下,在体积不变的容器中,若COS和H2的起始体积比为1:V,平衡后COS和H2的体积比为1:10V,则此温度下该反应的化学平衡常数K=$\frac{81V}{10(V-1)^{2}}$.
(1)已知反应2H2+O2=H2O为放热反应,下图能正确表示该反应中能量变化的是A.
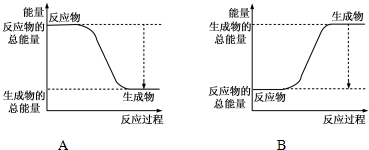
从断键和成键的角度分析上述反应中能量的变化.
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
(2)原电池可将化学能转化为电能.将质量相
同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是Zn,正极的反应式为Cu2++2e-=Cu,电解质溶液中SO42- 移向负极(填“正”或“负”).一段时间后,取出洗净、干燥、称量,二者质量差为12.9g.则导线中通过的电子的物质的量是0.2mol.
(3)一定温度下,将3molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为0.2mol/(L•min);X为2.若反应经2min达到平衡,平衡时C的浓度小于0.8mol/L(填“大于,小于或等于”).
| A. | 平衡常数K增大 | B. | a+b<c+d | C. | X的转化率下降 | D. | Z的体积分数增加 |
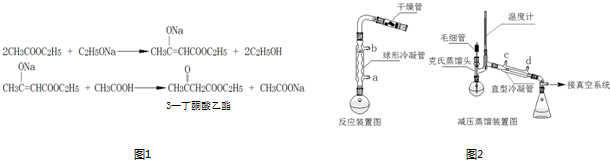
 CH3COOCH2CH3+H2O,反应类型是酯化反应.
CH3COOCH2CH3+H2O,反应类型是酯化反应.