题目内容
11.将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0,当反应达到平衡状态,测得混合气体总物质的量为2.1mol.则平衡时SO2的体积分数为9.5%.分析 化学平衡的计算,写出化学反应方程式,标出初始量、转化量和平衡量,根据条件列出式子,解题并不难.
解答 解:设参加反应的二氧化硫为nmol,则
2SO2(g)+O2(g)?2SO3(g)
初始量(mol):2 1 0
转化量(mol):n 0.5n n
平衡量(mol):2-n 1-0.5n n
已知平衡状态时,测得混合气体总物质的量为2.1mol,即:2-n+1-0.5n+n=2.1mol,解得n=1.8mol,所以平衡时,SO2的体积分数为$\frac{2-1.8}{2.1}$×100%=9.5%;
故答案为:9.5%.
点评 本题主要考察了化学平衡的计算,比较基础,难度较小.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
1.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3(s)+3H2(g)$\stackrel{高温}{?}$W(s)+3H2O(g)
(1)上述反应的化学平衡常数表达式为K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
第一阶段反应的化学方程式为2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为1:1:4.
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)?W(s)+2H2O (g)△H=+66.0kJ?mol-1
WO2(g)+2H2(g)?W(s)+2H2O (g)△H=-137.9kJ?mol-1
则WO2(s)?WO2(g),则WO2(s)?WO2 (g) 的△H=+203.9 kJ•mol-1.
(1)上述反应的化学平衡常数表达式为K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)?W(s)+2H2O (g)△H=+66.0kJ?mol-1
WO2(g)+2H2(g)?W(s)+2H2O (g)△H=-137.9kJ?mol-1
则WO2(s)?WO2(g),则WO2(s)?WO2 (g) 的△H=+203.9 kJ•mol-1.
19.在一密闭容器中,反应 mA(g)?nB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
| A. | 平衡向逆反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量分数减小了 | D. | m 小于n |
6.由Na+,Ca2+,OH-,Cl-,SO42-五种离子两两构成的物质中,属于盐的共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
16.甲、乙是两种常见短周期元素的单质,有关物质的转化关系如图所示.下列有关说法,错误的是( ) 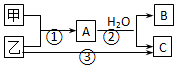

| A. | 若C为酸性气体,则B可能具有两性 | |
| B. | 若C是碱性气体,则B一定是碱 | |
| C. | 若B、C是两种酸,则B、C一定都是一元酸 | |
| D. | 以上3个转变可能都是氧化还原反应 |
20.为了证明化学反应有一定的限度,进行了如下探究活动:
步骤1:取8mL0.1mol•L-1的KI溶液于试管,滴加0.1mol•L-1的FeCl3溶液5~6滴,振荡;
请写出步骤1中发生的离子反应方程式:2Fe3++2I-=2Fe2++I2
步骤2:在上述试管中加入2mLCCl4,充分振荡、静置;
步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加0.1mol•L-1的KSCN溶液5~6滴,振荡,未见溶液呈血红色.
探究的目的是通过检验Fe3+,来验证是否有Fe3+残留,从而证明化学反应有一定的限度.针对实验现象,同学们提出了下列两种猜想:
猜想一:KI溶液过量,Fe3+完全转化为Fe2+,溶液无Fe3+
猜想二:Fe3+大部分转化为Fe2+,使生成Fe(SCN)3浓度极小,肉眼无法观察其颜色
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚比水轻且微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大.
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高.
结合新信息,请你完成以下实验:各取少许步骤2静置分层后的上层水溶液于试管A、B中,请将相关的实验操作、预期现象和结论填入下表空白处:
步骤1:取8mL0.1mol•L-1的KI溶液于试管,滴加0.1mol•L-1的FeCl3溶液5~6滴,振荡;
请写出步骤1中发生的离子反应方程式:2Fe3++2I-=2Fe2++I2
步骤2:在上述试管中加入2mLCCl4,充分振荡、静置;
步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加0.1mol•L-1的KSCN溶液5~6滴,振荡,未见溶液呈血红色.
探究的目的是通过检验Fe3+,来验证是否有Fe3+残留,从而证明化学反应有一定的限度.针对实验现象,同学们提出了下列两种猜想:
猜想一:KI溶液过量,Fe3+完全转化为Fe2+,溶液无Fe3+
猜想二:Fe3+大部分转化为Fe2+,使生成Fe(SCN)3浓度极小,肉眼无法观察其颜色
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚比水轻且微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大.
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高.
结合新信息,请你完成以下实验:各取少许步骤2静置分层后的上层水溶液于试管A、B中,请将相关的实验操作、预期现象和结论填入下表空白处:
| 实验操作 | 预期现象 | 结论 |
| 实验1:在试管A加入少量乙醚,充分振荡,静置 | 乙醚层呈红色 | “猜想一”不成立 |
| 实验2:取萃取后的上层清液滴加2-3滴 K4[Fe(CN)6]溶液 | 若产生蓝色沉淀 | 则“猜想二”成立 |
1.糖类、油脂、蛋白质是人体必须的三大营养物质.下列说法正确的是( )
| A. | 蔗糖和麦芽糖均能发生水解反应和银镜反应 | |
| B. | 植物油可用于萃取碘水中的碘 | |
| C. | 面粉、牛油、丝绸完全燃烧都只生成CO2和H2O | |
| D. | 用渗析的方法不能对鸡蛋白和淀粉的混合溶液进行分离 |
 如图为实验室制取乙酸乙酯的装置.
如图为实验室制取乙酸乙酯的装置.