题目内容
1.碳、硫和氮的氧化物与大气污染密切相关,对CO2、SO2和NO2的研究很有意义.(1)科学家发现NOx与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(g)?NaNO3(g)+ClNO(g)△H1<0(平衡常数为K1)
II:ZNO(g)+Cl(g)?2ClNO(g)△H2<0(平衡常数为K2)
III:4NO2(g)+2NaCl(g)?2NaNO2(g)+2NO(g)+Cl2(g)△H3 (平衡常数为K3)
反应III中K3=$\frac{{K}_{1}^{2}}{{K}_{2}}$(用K1、K2表示),△H3=2△H1-△H2(用△H1、△H2表示).若反应 II在恒温、恒容条件下进行,能判断该反应一定达到平衡状态的标志是AD.
A.容器内混合气体的压强保持不变
B.v正(NO)=v逆(Cl2)
C.容器内混合气体的密度保持不变
D.容器内混合气体的平均相对分子质量保持不变
(2)汽车尾气中排放的NOx和CO会污染环境,在汽车尾气系统中安装催化转化器,可有效降低NOx和CO的排放,为了模拟应:2NO(g)+2CO(g)?N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO(g)和CO(g)的浓度如表:
| 时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
此溫度下,该反应的平衡常数K=5000.
(3)科学家提出由CO2制取C的工艺如图1所示.已知:在重整系统中n(FeO):n(CO2)=5:1则在“热分解系统”中,FexOy的化学式为Fe5O7.

(4)NQx可“变废为宝”,由NO电解可制备NH4NO3,其工作原理如图2所示(M、N为多孔电极).为使电解产物全部转化为NH4NO3,需向电解产物中补充适量NH3.电解时M和电源负 极(填“正或负”)相连,书写N极发生的电极反应式.
分析 (1)已知:Ⅰ、2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),
Ⅱ、2NO(g)+Cl2(g)?2ClNO(g),
根据盖斯定律①×2-②可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),由此计算该反应平衡常数和△H3,可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
(2)由图表可知反应进行到4s时达到平衡状态,
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始浓度(10-4mol/L) 10 36 0 0
变化浓度(10-4mol/L) 9 9 4.5 9
平衡浓度(10-4mol/L) 1.0 27 4.5 9
根据反应物的转化率和平衡常数计算公式计算即可;
(3)由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,根据原子守恒确定FexOy的化学式;
(4)电解NO制备NH4NO3,M极发生还原反应为阴极,N极NO被氧化为NO3-是阳极,据此分析判断并写出N极电极反应式.
解答 解:(1)2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1 △H<0 (I)
2NO(g)+Cl2(g)?2ClNO(g) K2 △H<0 (II)
根据盖斯定律,Ⅰ×2-Ⅱ可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数K=$\frac{{K}_{1}^{2}}{{K}_{2}}$,△H3=2△H1-△H2;
A.在恒温、恒容条件下,反应2NO(g)+Cl2(g)?2ClNO(g)进行过程中气体总物质的量不断变化,压强也在变化,当容器内混合气体的压强保持不变,说明达到平衡状态,故A正确;
B.当v正(NO)=2v逆(Cl2)时,反应达到平衡状态,故B错误;
C.混合气体的质量和体积始终不变,则容器内混合气体的密度保持不变,无法判断是平衡状态,故C错误;
D.混合气体的质量和始终不变,气体的总物质的量不确定,当容器内混合气体的平均相对分子质量保持不变时,反应达到平衡状态,故D正确;
故答案为:$\frac{{K}_{1}^{2}}{{K}_{2}}$;2△H1-△H2;AD;
(2)由图表可知反应进行到4s时达到平衡状态,
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始浓度(10-4mol/L) 10 36 0 0
变化浓度(10-4mol/L) 9 9 4.5 9
平衡浓度(10-4mol/L) 1.0 27 4.5 9
平衡时,NO的转化率ɑ(NO)=$\frac{9×1{0}^{-4}mol/L}{10×1{0}^{-4}mol/L}×100%$=90%;
此溫度下,该反应的平衡常数K=$\frac{c({N}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$=$\frac{(4.5×1{0}^{-4}mol/L)×(9×1{0}^{-4}mol/L)^{2}}{(1.0×1{0}^{-4}mol/L)^{2}×(27×1{0}^{-4}mol/L)^{2}}$=5000,
故答案为:90%;5000;
(3)由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中n(FeO):n(CO2)=5:1,根据Fe原子、O原子守恒可知x:y=5:(5+2)=5:7,故FexOy的化学式为Fe5O7;
故答案为:Fe5O7;
(4)电解NO制备NH4NO3,M极发生还原反应为电解池的阴极,连接电源的负极,而N极上发生氧化反应,其电极反应式为NO-3e-+2H2O=NO3-+4H+,
故答案为:负;NO-3e-+2H2O=NO3-+4H+.
点评 本题考查化学平衡状态的判断及计算、盖斯定律的应用以及电解原理的应用等知识,较为综合,考查对图表分析提取信息能力等,为高考常见题型,题目难度中等.

| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-H | 414 | C-F | 489 | H-F | 565 | F-F | 158 |
| H-H | 436 | H-N | 391 |
CH4(g)+4F2(g)═CF4(g)+4HF(g)△H
②根据键能和反应热化学方程式$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g )
△H=-46kJ•mol-1 计算N≡N的键能.
| A. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| B. | 在一定条件下,苯与液溴、浓硝酸、浓硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| C. | 将少量钠投入到盛有水和乙醇的烧杯中,比较水和乙醇中氢的活泼性 | |
| D. | 聚合物 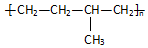 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
| A. | 11种 | B. | 10种 | C. | 9种 | D. | 8种 |

已知:1)有关钴、镍、镁、铁化合物的性质见下表:
| 化学式 | 沉淀开始时的pH | 沉淀完全时的pH | 有关性质 |
| Co(OH)2 | 7.2 | 9.4 | Co+2HCl═CoCl2+H2↑ Co2++2NH3•H2O═Co(OH)2↓+2NH4+ Co2++2H2O?Co(OH)2+2H+ Ni+2HCl═NiCl2+H2↑ Ni2++6NH3•H2O═Ni(NH3)6]2++6H2O |
| Fe(OH)2 | 7.1 | 9.6 | |
| Fe(OH)3 | 2.3 | 3.7 | |
| Mg(OH)2 | 10.8 | 12.4 |
请回答:
(1)“除镍”步骤必须控制在一定时间内完成,否则沉淀中将有部分Co(OH)2转化为Co(OH)3,此反应的化学方程式为4Co(OH)2+O2+2H2O=4Co(OH)3
(2)在“盐酸调pH=4”步骤中,加入盐酸的作用是防止Co2+水解.
(3)“净化”步骤中加入H2O2的作用是2Fe2++2H++H2O2=2H2O+2Fe3+(请用离子方程式表示).废渣的成分MgF2、Fe(OH)3(请用化学式表示).
(4)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O?Fe(OH)3+3H+的平衡常数K=2.5×10-5.
(5)二水合草酸钴晶体(CoC2O4•2H2O)中C元素的化合价为+3,在空气中高温反应的化学方程式为2CoC2O4•2H2O+O2=2CoO+4H2O+4CO2.


 .
. .
. =O$→_{H+}^{ROH}$
=O$→_{H+}^{ROH}$
 ,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应.写出制备化合物
,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应.写出制备化合物  的最后一步反应的化学方程式
的最后一步反应的化学方程式 .
. 氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节.回答下列问题:
氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节.回答下列问题: