题目内容
12.下列说法不正确的是( )| A. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| B. | 在一定条件下,苯与液溴、浓硝酸、浓硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| C. | 将少量钠投入到盛有水和乙醇的烧杯中,比较水和乙醇中氢的活泼性 | |
| D. | 聚合物 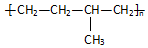 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
分析 A.己烷有五种同分异构体;
B.有机物分子中的原子或原子团被其它原子或原子团所取代的反应为取代反应;
C.水为弱电解质,可电离,乙醇为非电解质;
D.凡链节主链上只有四个碳原子(无其它原子)且链节无双键的高聚物,其单体必为两种,在正中间画线断开,然后将四个半键闭合即可.
解答 解:A.己烷有五种同分异构体,其碳链结构分别为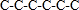 、
、 、
、 、
、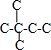 、
、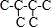 ,己烷同分异构体为不同物质,所以其熔沸点不同,且含有支链越多其熔沸点越低,故A错误;
,己烷同分异构体为不同物质,所以其熔沸点不同,且含有支链越多其熔沸点越低,故A错误;
B.在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应,是苯中的氢原子被溴原子、硝基、磺基取代,所以都属于取代反应,故B正确;
C.水易与钠反应,较剧烈,可说明水和乙醇中氢的活泼性的强弱,故C正确;
D.凡链节主链上只有四个碳原子(无其它原子)且链节无双键的高聚物,其单体必为两种,在正中间画线断开,然后将四个半键闭合即可,所以聚合物( )的单体是CH3CH=CH2和CH2=CH2,故D正确;
)的单体是CH3CH=CH2和CH2=CH2,故D正确;
故选A.
点评 本题考查综合考查有机物的结构和性质,为高考常见题型和高频考点,涉及高聚物单体判断、取代反应判断、同分异构体种类判断等知识点,侧重考查基本概念、基本理论,这些都是高频考点,难点是同分异构体种类判断,要考虑官能团异构、官能团位置结构、碳链异构,易错选项是D.

练习册系列答案
相关题目
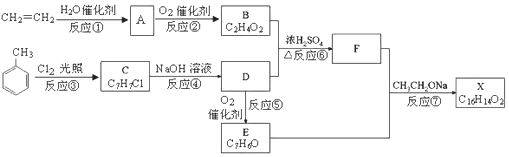
20.用相对分子质量为57的烷基取代甲苯苯环上的一个氢原子所得芳香烃产物的数目有( )
| A. | 3种 | B. | 4种 | C. | 6种 | D. | 12种 |
7.氟烷(分子式C2HF3ClBr)可以看作乙烷中的H原子被F、Br、Cl等原子取代的产物.它是一种全身麻醉药,根据你所学知识判断,它的同分异构体数目为(不考虑立体异构)( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
17.用HNO3和HF的混酸处理某金属后,产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-等.下图是综合利用该酸洗废液的工艺流程:

已知:
①金属离子开始沉淀和沉淀完全时的pH:
②Ni2+与足量氨水的反应为:Ni2++6NH3?[Ni(NH3)6]2+
(1)再生酸中含有HNO3,采取减压蒸馏的目的为降低蒸馏的温度以减少硝酸的分解.
(2)滤渣1的主要成分为:Fe(OH)3和少量氧化铁.
(3)“转化”时NaHSO3与Cr2O72-发生反应的氧化剂与还原剂的物质的量之比:1:3.
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3.
(5)滤渣3的主要成分为CaSO4、Ca(OH)2和CaF2.
(6)经检测,最后的残液中c(Ca2+)=0.001mol•L-1,则残液中F-浓度为3.8
Mg•L-1,符合(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10mg•L-1].

已知:
①金属离子开始沉淀和沉淀完全时的pH:
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
(1)再生酸中含有HNO3,采取减压蒸馏的目的为降低蒸馏的温度以减少硝酸的分解.
(2)滤渣1的主要成分为:Fe(OH)3和少量氧化铁.
(3)“转化”时NaHSO3与Cr2O72-发生反应的氧化剂与还原剂的物质的量之比:1:3.
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3.
(5)滤渣3的主要成分为CaSO4、Ca(OH)2和CaF2.
(6)经检测,最后的残液中c(Ca2+)=0.001mol•L-1,则残液中F-浓度为3.8
Mg•L-1,符合(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10mg•L-1].
1.碳、硫和氮的氧化物与大气污染密切相关,对CO2、SO2和NO2的研究很有意义.
(1)科学家发现NOx与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(g)?NaNO3(g)+ClNO(g)△H1<0(平衡常数为K1)
II:ZNO(g)+Cl(g)?2ClNO(g)△H2<0(平衡常数为K2)
III:4NO2(g)+2NaCl(g)?2NaNO2(g)+2NO(g)+Cl2(g)△H3 (平衡常数为K3)
反应III中K3=$\frac{{K}_{1}^{2}}{{K}_{2}}$(用K1、K2表示),△H3=2△H1-△H2(用△H1、△H2表示).若反应 II在恒温、恒容条件下进行,能判断该反应一定达到平衡状态的标志是AD.
A.容器内混合气体的压强保持不变
B.v正(NO)=v逆(Cl2)
C.容器内混合气体的密度保持不变
D.容器内混合气体的平均相对分子质量保持不变
(2)汽车尾气中排放的NOx和CO会污染环境,在汽车尾气系统中安装催化转化器,可有效降低NOx和CO的排放,为了模拟应:2NO(g)+2CO(g)?N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO(g)和CO(g)的浓度如表:
平衡时,NO的转化率ɑ(NO)=90%,
此溫度下,该反应的平衡常数K=5000.
(3)科学家提出由CO2制取C的工艺如图1所示.已知:在重整系统中n(FeO):n(CO2)=5:1则在“热分解系统”中,FexOy的化学式为Fe5O7.

(4)NQx可“变废为宝”,由NO电解可制备NH4NO3,其工作原理如图2所示(M、N为多孔电极).为使电解产物全部转化为NH4NO3,需向电解产物中补充适量NH3.电解时M和电源负 极(填“正或负”)相连,书写N极发生的电极反应式.
(1)科学家发现NOx与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(g)?NaNO3(g)+ClNO(g)△H1<0(平衡常数为K1)
II:ZNO(g)+Cl(g)?2ClNO(g)△H2<0(平衡常数为K2)
III:4NO2(g)+2NaCl(g)?2NaNO2(g)+2NO(g)+Cl2(g)△H3 (平衡常数为K3)
反应III中K3=$\frac{{K}_{1}^{2}}{{K}_{2}}$(用K1、K2表示),△H3=2△H1-△H2(用△H1、△H2表示).若反应 II在恒温、恒容条件下进行,能判断该反应一定达到平衡状态的标志是AD.
A.容器内混合气体的压强保持不变
B.v正(NO)=v逆(Cl2)
C.容器内混合气体的密度保持不变
D.容器内混合气体的平均相对分子质量保持不变
(2)汽车尾气中排放的NOx和CO会污染环境,在汽车尾气系统中安装催化转化器,可有效降低NOx和CO的排放,为了模拟应:2NO(g)+2CO(g)?N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO(g)和CO(g)的浓度如表:
| 时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
此溫度下,该反应的平衡常数K=5000.
(3)科学家提出由CO2制取C的工艺如图1所示.已知:在重整系统中n(FeO):n(CO2)=5:1则在“热分解系统”中,FexOy的化学式为Fe5O7.

(4)NQx可“变废为宝”,由NO电解可制备NH4NO3,其工作原理如图2所示(M、N为多孔电极).为使电解产物全部转化为NH4NO3,需向电解产物中补充适量NH3.电解时M和电源负 极(填“正或负”)相连,书写N极发生的电极反应式.
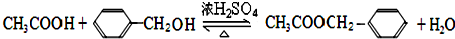 .
.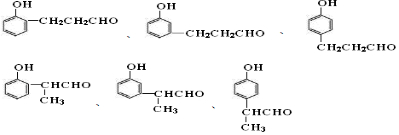 中的任意一种.
中的任意一种.