题目内容
18. 向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.其中甲充入2molSO2、1molO2,乙充入1molSO2、0.5molO2,一段时间后达到平衡时,测得两容器中c(SO2)[mol•L-1]随时间t(min)的变化关系如图所示.下列说法正确的是( )
向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.其中甲充入2molSO2、1molO2,乙充入1molSO2、0.5molO2,一段时间后达到平衡时,测得两容器中c(SO2)[mol•L-1]随时间t(min)的变化关系如图所示.下列说法正确的是( )| A. | 压强:p(甲)<2p(乙) | |
| B. | 热量:Q(甲)<2Q(乙) | |
| C. | 乙中前5min内的反应速率v(O2)=0.10mol•L-1•min-1 | |
| D. | 保持其他条件不变,若起始时向乙中充入0.4molSO2、0.2molO2、0.4molSO3,则此时v(正)<v(逆) |
分析 A.该反应反应前气体体积大于反应后体积,即充入反应物物质的量越大则压强越大,进行程度较大,据此分析压强大小;
B.该反应反应前气体体积大于反应后体积,即充入反应物物质的量越大则压强越大,进行程度较大,据此分析热量关系;
C.计算乙中前5 min内SO2浓度变化得到v(O2);
D.利用浓度商与化学平衡常数比较判断.
解答 解:A.该反应反应前气体体积大于反应后体积,即充入反应物物质的量越大则压强越大,进行程度较大,则压强p(甲)<2p(乙),故A正确;
B.该反应反应前气体体积大于反应后体积,即充入反应物物质的量越大则压强越大,进行程度较大,放出热量Q(甲)>2Q(乙),故B错误;
C.乙中前5 min内SO2浓度变化为1mol/L-0.5mol/L-0.5mol/L,v(SO2)=$\frac{0.5mol/L}{5min}$=0.10mol/(L•min),则v(O2)=$\frac{1}{2}$v(SO2)=$\frac{1}{2}$×0.1=0.050mol/(L•min),故C错误;
D.乙容器达到化学平衡状态时,SO2浓度为0.5mol/L,O2浓度为:0.5mol/L-$\frac{1}{2}$=0.25mol/L,SO3浓度等于SO2浓度变化为0.5mol/L,K=$\frac{(0.5mol/L)^{2}}{(0.5mol/L)^{2}×0.25mol/L}$=4,浓度商为:$\frac{(0.4mol/L)^{2}}{(0.4mol/L)^{2}×0.2mol/L}$=5,浓度商大于化学平衡常数,化学平衡向逆反应方向移动,即v(正)<v(逆),故D正确;
故选AD.
点评 本题考查化学平衡图象、影响平衡的因素、化学反应速率的计算等,难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
18.X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Y的轨道表示式为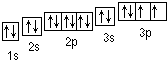 ;
;
(2)X、Y、Z三种元素的原子半径从大到小的顺序是S>Cl>C(用元素符号表示);
(3)XY2的分子中存在2个σ键,分子的空间构形为直线形,在H-Y、H-Z两种共价键中,键长较长的是H-S;
(4)W3+的核外电子排布式是1s22s22p63s23p63d5;
(5)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y.此反应的化学方程式是2CO+SO2=S+2CO2;
(6)请设计一个实验方案,比较Y、Z单质氧化性的强弱在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为56,中子数为30 |
 ;
;(2)X、Y、Z三种元素的原子半径从大到小的顺序是S>Cl>C(用元素符号表示);
(3)XY2的分子中存在2个σ键,分子的空间构形为直线形,在H-Y、H-Z两种共价键中,键长较长的是H-S;
(4)W3+的核外电子排布式是1s22s22p63s23p63d5;
(5)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y.此反应的化学方程式是2CO+SO2=S+2CO2;
(6)请设计一个实验方案,比较Y、Z单质氧化性的强弱在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
9.化学使人类生活得更美好的一门自然科学.下列说法正确的是( )
| A. | 豆浆富含蛋白质,煮沸后蛋白质变成了氨基酸 | |
| B. | 浓硫酸可刻蚀石英制艺术品 | |
| C. | 氢氧化铝可作胃酸的中和剂 | |
| D. | 装饰材料中释放的甲醛、苯不会造成污染 |
6.下列关于有机化合物的叙述中不正确的是( )
| A. | 丙烷跟甲烷一样能与氯气发生取代反应 | |
| B. | 相同条件,等物质的量的乙醇、乙二醇、丙三醇中分别加入足量的金属钠产生氢气的体积之比是2:3:6 | |
| C. | CH2Cl2只有一种结构说明甲烷是四面体结构而不是正方形结构 | |
| D. | 溴水既可鉴别乙烷与乙烯,又可除去乙烷中的乙烯而得到纯净的乙烷 |
13.如图装置可用来监测空气中NO的含量,下列说法不正确的是( )


| A. | 电子由Pt电极流出,经外电路流向NiO电极 | |
| B. | Pt电极上发生的是还原反应 | |
| C. | NiO电极的电极反应式为NO+O2--2e-═NO2 | |
| D. | 每转移2 mol电子,有1 mol O2-迁移到负极 |
3.下列实验中,所采取的实验操作或方法与对应的原理均正确的是( )
| 选项 | 实验目的 | 实验操作或方法 | 实验的原理 |
| A | 除去KNO3固体中的NaCl | 滴加过量的AgNO3溶液,过滤,蒸发,干燥 | Cl-+Ag+=AgCl↓ |
| B | 检验NaI中含有I- | 滴加淀粉溶液 | 碘遇淀粉变蓝色 |
| C | 制备FeCl2粉末 | 加热条件下向过量铁粉中通入少量Cl2 | 过量的Fe与Cl2反应生成产物是FeCl2 |
| D | 分离乙酸乙酯和乙醇 | 加入饱和碳酸钠溶液,分液、蒸馏 | 乙酸乙酯和乙醇在饱和碳酸钠溶液中溶解度不同及乙醇沸点低 |
| A. | A | B. | B | C. | C | D. | D |
10.下列叙述不正确的是( )
| A. | 生理盐水的浓度为0.9% | |
| B. | 阿司匹林具有解热镇痛的作用 | |
| C. | 垃圾是放错地方的资源,应分类回收利用 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
7.下列离子方程式正确的是( )
| A. | 氯气和水发生反应 Cl2+H2O═2 H++Cl-+ClO- | |
| B. | 金属钠和水反应 Na+2H2O═H2↑+2OH-+Na+ | |
| C. | 用氢氧化钠除去铝表面的氧化膜时产生气泡的反应2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 将金属铁加入稀硫酸和硝酸钾混合溶液中,金属溶解Fe+2H+═Fe2++H2↑ |



