题目内容
7.下列离子方程式正确的是( )| A. | 氯气和水发生反应 Cl2+H2O═2 H++Cl-+ClO- | |
| B. | 金属钠和水反应 Na+2H2O═H2↑+2OH-+Na+ | |
| C. | 用氢氧化钠除去铝表面的氧化膜时产生气泡的反应2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 将金属铁加入稀硫酸和硝酸钾混合溶液中,金属溶解Fe+2H+═Fe2++H2↑ |
分析 A.次氯酸为弱酸应保留化学式;
B.电荷不守恒;
C.铝与氢氧化钠反应生成偏铝酸钠和氢气;
D.不符合反应客观事实;
解答 解:A.氯气和水发生反应,离子方程式:Cl2+H2O═H++Cl-+HClO,故A错误;
B.金属钠和水反应,离子方程式:2 Na+2H2O═H2↑+2OH-+2Na+,故B错误;
C.用氢氧化钠除去铝表面的氧化膜时产生气泡的反应,离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑,故C正确;
D.将金属铁加入稀硫酸和硝酸钾混合溶液中,硝酸根离子在酸性环境下与金属反应不能生成氢气,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确离子方程式书写方法及反应实质是解题关键,注意离子反应遵循客观事实,题目难度不大.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
7.含有一个三键的炔烃,加氢后产物的键线式为 ,这种炔烃有( )
,这种炔烃有( )
 ,这种炔烃有( )
,这种炔烃有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
18. 向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.其中甲充入2molSO2、1molO2,乙充入1molSO2、0.5molO2,一段时间后达到平衡时,测得两容器中c(SO2)[mol•L-1]随时间t(min)的变化关系如图所示.下列说法正确的是( )
向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.其中甲充入2molSO2、1molO2,乙充入1molSO2、0.5molO2,一段时间后达到平衡时,测得两容器中c(SO2)[mol•L-1]随时间t(min)的变化关系如图所示.下列说法正确的是( )
 向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.其中甲充入2molSO2、1molO2,乙充入1molSO2、0.5molO2,一段时间后达到平衡时,测得两容器中c(SO2)[mol•L-1]随时间t(min)的变化关系如图所示.下列说法正确的是( )
向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.其中甲充入2molSO2、1molO2,乙充入1molSO2、0.5molO2,一段时间后达到平衡时,测得两容器中c(SO2)[mol•L-1]随时间t(min)的变化关系如图所示.下列说法正确的是( )| A. | 压强:p(甲)<2p(乙) | |
| B. | 热量:Q(甲)<2Q(乙) | |
| C. | 乙中前5min内的反应速率v(O2)=0.10mol•L-1•min-1 | |
| D. | 保持其他条件不变,若起始时向乙中充入0.4molSO2、0.2molO2、0.4molSO3,则此时v(正)<v(逆) |
15.下列图示与对应的叙述相符的是( )
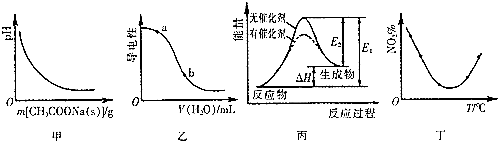

| A. | 图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 | |
| B. | 图乙表示向NH3•H2O溶液中加水时溶液的导电性变化,则NH3•H2O溶液的pH:a<b | |
| C. | 图丙表示催化剂能改变化学反应的活化能 | |
| D. | 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则反应的△H>0 |
2.聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示.下列有关说法不正确的是( )


| A. | M与A均能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | B能发生消去、氧化、取代、缩聚等反应 | |
| C. | 1 mol M与足量烧碱溶液反应,可消耗2n mol NaOH | |
| D. | A、B、C各1 mol分别与金属钠反应,放出气体的物质的量之比为1:2:2 |
12.在N2O4(g)?2NO2(g)平衡体系中,增大N2O4的浓度,则NO2和N2O4的物质的量之比,下列叙述正确的是( )
| A. | 一定增大 | B. | 一定减小 | ||
| C. | 一定不变 | D. | 可能减小也可能不变 |
19.下列化学用语书写正确的是( )
| A. | 1个氖原子 Na | B. | +2价的铁元素 Fe+2 | ||
| C. | 2个氢分子 2H | D. | 4个铵根离子 4NH4+ |
 请根据所学化学反应原理,解决以下问题:
请根据所学化学反应原理,解决以下问题: