题目内容
下列离子方程式正确的是( )
| A、饱和碳酸钠溶液中通入过量的CO2:CO32-+H2O+CO2=2HCO3- |
| B、氯气跟水反应:Cl2+H2O=2H++Cl-+ClO- |
| C、过氧化钠投入水中:Na2O2+H2O=2Na++2OH-+O2↑ |
| D、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
考点:离子方程式的书写
专题:离子反应专题
分析:A、碳酸氢钠的溶解度小于碳酸钠的溶解度;
B、HClO是弱酸,不能拆;
C、从质量守恒角度来分析;
D、氯化铝溶液中加入过量的氨水,氢氧化铝不溶于氨水.
B、HClO是弱酸,不能拆;
C、从质量守恒角度来分析;
D、氯化铝溶液中加入过量的氨水,氢氧化铝不溶于氨水.
解答:
解:A、向饱和碳酸钠溶液中通入足量二氧化碳气体,离子方程式:2Na++CO32-+H2O+CO2=2NaHCO3↓,故A错误;
B、向水中通入氯气,离子方程式为:Cl2+H2O?H+Cl-+HClO,故B错误;
C、过氧化钠投入水中的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑,故C错误;
D、氯化铝溶液中加入过量的氨水,氢氧化铝不溶于氨水,故D正确.
故选D.
B、向水中通入氯气,离子方程式为:Cl2+H2O?H+Cl-+HClO,故B错误;
C、过氧化钠投入水中的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑,故C错误;
D、氯化铝溶液中加入过量的氨水,氢氧化铝不溶于氨水,故D正确.
故选D.
点评:本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析.

练习册系列答案
相关题目
现有一瓶乙酸乙酯和冰醋酸的混合物,已知它们的性质如下表,据此,将乙酸乙酯和冰醋酸互相分离的最佳方法是( )
| 物质名称 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/g?mL-1 | 溶解性 |
| 乙酸乙酯 | C4H8O2 | -83.6 | 77.06 | 0.898 | 微溶于水,溶于醇等多数有机溶剂 |
| 冰醋酸 | C2H4O2 | 16.6 | 117.9 | 1.049 | 易溶于水和乙醇及其他有机溶剂 |
| A、饱和Na2CO3溶液萃取法 |
| B、升华法 |
| C、水洗分液法 |
| D、蒸馏法 |
下列实验中,不会产生沉淀的是( )
| A、CO2通入水玻璃中 |
| B、CO2 通入偏铝酸钠溶液中 |
| C、SO2通入氯化钡溶液中 |
| D、SO2通入氢氧化钙溶液中 |
以下物质间的每步转化通过一步反应就能实现的是( )
| A、Al→Al2O3→Al(OH)3→NaAlO2 |
| B、Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
| C、N2→NO→NO2→HNO3 |
| D、S→SO3→H2SO4→MgSO4 |
下列离子在溶液中能大量共存,通CO2后仍能大量存在的一组是( )
| A、K+、Ba2+、ClO-、NO3- |
| B、Na+、HCO3-、OH-、Al3+ |
| C、Na+、MnO4-、Br -、NO3- |
| D、K+、Ag+、NH4+、NO3- |
下列实验现象或反应,不是由于发生取代反应而引起的是( )
| A、乙酸与乙醇在浓硫酸作用下加热反应 |
| B、苯和浓硝酸、浓硫酸在50-60℃水浴中加热反应 |
| C、硬脂酸甘油酯在碱性条件下水解得到甘油和肥皂 |
| D、乙烯通入溴的四氯化碳溶液中,溶液褪色 |
下列分子或离子之间互为等电子体的是( )
| A、CCl4和PO43- |
| B、NH3和NH4+ |
| C、NO2和CS2 |
| D、CO2和SO2 |
近年来研制的NF3气体可用作氟化氢-氟化氚高能化学激光器的氟源,也可作为火箭推进剂,NF3可用NH3与氟气制取,化学方程式为:4NH3+3F2═NF3+3NH4F,下列说法中不正确的是( )
A、NF3的形成过程用电子式可表示为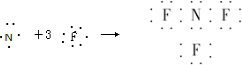 |
| B、NF3的氧化性大于F2 |
| C、NF3分子空间构型为三角锥形 |
| D、NH4F中既有离子键又有极性共价键 |
 .
.