题目内容
常温条件下,下列各组比值为1:2的是( )
| A、0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+)之比 |
| B、0.1 mol/L与0.2 mol/L 醋酸溶液,c(H+) 之比 |
| C、pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比 |
| D、pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比 |
考点:弱电解质在水溶液中的电离平衡,盐类水解的原理
专题:
分析:A、碳酸钠中,碳酸根离子会发生水解;
B、醋酸的电离程度和酸的浓度有关,越稀越电离;
C、pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比可以根据电荷守恒来回答;
D、氢氧化钡是强碱,氨水是弱碱,据此回答.
B、醋酸的电离程度和酸的浓度有关,越稀越电离;
C、pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比可以根据电荷守恒来回答;
D、氢氧化钡是强碱,氨水是弱碱,据此回答.
解答:
解:A、碳酸钠中,碳酸根离子会发生水解,c(CO32-)与c(Na+)之比小于1:2,故A错误;
B、醋酸的电离程度和酸的浓度有关,越稀越电离,即0.1 mol/L的醋酸电离程度大,所以0.1 mol/L与0.2 mol/L 醋酸溶液,c(H+) 之比大于1:2,故B错误;
C、pH=3的硫酸与醋酸溶液,氢离子浓度相等,氢氧根离子浓度也是相等的,根据电荷守恒,所以c(SO42-)与c(CH3COO-)之比等于2:1,故C正确;
D、氢氧化钡是强碱,氨水是弱碱,pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比小于1:2,故D错误.
故选C.
B、醋酸的电离程度和酸的浓度有关,越稀越电离,即0.1 mol/L的醋酸电离程度大,所以0.1 mol/L与0.2 mol/L 醋酸溶液,c(H+) 之比大于1:2,故B错误;
C、pH=3的硫酸与醋酸溶液,氢离子浓度相等,氢氧根离子浓度也是相等的,根据电荷守恒,所以c(SO42-)与c(CH3COO-)之比等于2:1,故C正确;
D、氢氧化钡是强碱,氨水是弱碱,pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比小于1:2,故D错误.
故选C.
点评:本题考查了盐的水解和弱电解质的电离原理,注意把握盐的水解对盐电离出来的离子浓度的影响,题目难度不大.

练习册系列答案
相关题目
通过复习总结,你认为下列对化学知识概括合理的组合是( )
①金属晶体中存在离子,但却不存在离子键
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
④NF3的沸点比NH3的沸点低是因为N-F比N-H键的键能大
⑤过氧化氢和液氮的分子中都有非极性共价键
⑥共价化合物中可能含有离子键
⑦非极性分子中一定含有非极性键.
①金属晶体中存在离子,但却不存在离子键
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
④NF3的沸点比NH3的沸点低是因为N-F比N-H键的键能大
⑤过氧化氢和液氮的分子中都有非极性共价键
⑥共价化合物中可能含有离子键
⑦非极性分子中一定含有非极性键.
| A、只有②④⑤ |
| B、只有②③⑥ |
| C、只有①③⑤ |
| D、只有④⑤⑦ |
下列有关化学用语使用正确的是( )
A、硫原子的原子结构示意图: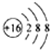 | ||
B、NH4Cl的电子式: | ||
C、原子核内有18个中子的氯原子:
| ||
D、NH3 的电子式: |
下列关于某温度下一定浓度氨水的说法正确的是( )
| A、NH3?H2O电离达到平衡的标志是溶液呈电中性 | ||
B、
| ||
| C、氨水促进了水的电离 | ||
D、c(NH
|
下列物质中酸性最强的是( )
| A、HClO4 |
| B、H2SO4 |
| C、H3PO4 |
| D、H2SiO4 |
下列叙述正确的是( )
| A、向Al2(SO4)3溶液中滴加过量的NaOH溶液制备Al(OH)3 |
| B、向水玻璃中滴加盐酸制备硅酸 |
| C、用加热法除去Ca(OH)2固体中混有的NH4Cl固体 |
| D、SO2通入酸性KMnO4溶液检验其漂白性 |



