题目内容
9.实验室现需配制物质的量浓度为1mol•L-1的NaOH溶液480mL.(1)配制该溶液的实验步骤包括:
a.计算需要氢氧化钠固体的质量;
b.称量氢氧化钠固体;
c.将烧杯中的溶液注入500 mL容量瓶;
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却;
e.盖好瓶塞,反复上下颠倒,摇匀;
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切.
①实验过程中用到的玻璃仪器有:烧杯、量筒、玻璃棒、500 mL容量瓶、胶头滴管.
②上述步骤的正确操作顺序是a b d c f e.
(2)要配制此溶液,需要称量NaOH固体的质量为20.0克.
(3)下列操作会使所配制溶液浓度偏大的有A.
A.溶解固体溶质时,未冷却至室温即转入容量瓶进行定容
B.定容摇匀后,静置时发现液面低于刻度线,又加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时观察液面仰视
(4)配制好的NaOH溶液不能用带磨口玻璃塞的试剂瓶存放,请用化学方程式解释原因SiO2+2NaOH=Na2SiO3+H2O.
分析 (1)①依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器,判断缺少的仪器,注意容量瓶规格选择应依据配制溶液体积;
②依据配制一定物质的量浓度溶液的一般步骤排序;
(2)依据m=CVM计算需要溶质的质量;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)二氧化硅与氢氧化钠溶液反应生成具有粘性的硅酸钠溶液,能够将玻璃塞与玻璃瓶粘到一起.
解答 解:(1)①配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶等,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,配制NaOH溶液480mL,应选择500mL容量瓶,所以缺少的仪器:500 mL容量瓶、胶头滴管;
溶质溶解冷却后,应将溶液转移到500mL容量瓶,定容时继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
故答案为:500 mL容量瓶、胶头滴管;
②配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶等,所以正确的操作顺序为:a b d c f e;
(2)配制物质的量浓度为1mol•L-1的NaOH溶液480mL,应选择500mL容量瓶,实际配制500mL溶液,需要氢氧化钠质量m=1mol/L×0.5L×40g/mol=20.0g;
故答案为:20.0;
(3)A.溶解固体溶质时,未冷却至室温即转入容量瓶进行定容,冷却后,溶液体积偏小,溶液浓度偏高,故A选;
B.定容摇匀后,静置时发现液面低于刻度线,又加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故B不选;
C.容量瓶中原有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故C不选;
D.定容时观察液面仰视,导致溶液体积偏大,溶液浓度偏低,故D不选;
故选:A;
(4)二氧化硅与氢氧化钠溶液反应生成具有粘性的硅酸钠溶液,能够将玻璃塞与玻璃瓶粘到一起,化学方程式:SiO2+2NaOH=Na2SiO3+H2O;
故答案为:SiO2+2NaOH=Na2SiO3+H2O.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧,题目难度不大.

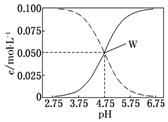 常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )
常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )| A. | pH=5.75的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | pH=7,c(Na+)=0.1 mol•L-1,c( CH3COOH)>c(Na+)=c( CH3COO-)>c(H+)=c(OH-) | |
| C. | pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol•L-1 | |
| D. | 向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
| A. | 糖类、油脂、蛋白质均属于营养物质 | B. | 甲烷、乙醇、葡萄糖均属于有机物 | ||
| C. | NaOH与H2SO4均属于电解质 | D. | 纯碱、烧碱均属于碱 |
| A. | S2- | B. | Fe2+ | C. | SO32- | D. | K+ |
| 选项 | 陈述I | 陈述Ⅱ |
| A | HClO具有强氧化性 | HClO有杀菌消毒作用 |
| B | 铝比铁活泼 | 铝比铁更容易被腐蚀 |
| C | 与水反应时,钠浮在水面上 | 钠与水反应是放热反应 |
| D | 浓硝酸具有强氧化性 | 浓硝酸能和浓氨水反应产生白烟 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 新制氯水使有色布条褪色 | B. | 过氧化钠使某些染料褪色 | ||
| C. | SO2漂白纸浆 | D. | 活性炭使红墨水褪色 |
| A. | 1.4g | B. | 2.8g | C. | 5.6g | D. | 11.2g |
| A. | pH=3的0.1mol•L-1的NaHC2O4溶液中:c(H+)=c(OH)+c(C2O42-) | |
| B. | 0.1mol•L-1的(NH4)2S溶液中:c(NH4+)=2c(S2-)+2c(HS-)+2c(H2S) | |
| C. | pH=4的CH3COOH溶液中:$\frac{c(C{H}_{3}CO{O}^{-})}{c(O{H}^{-})•c(C{H}_{3}COOH)}$<1 | |
| D. | 等物质的量浓度,等体积的NaF溶液和HF溶液混合所得稀溶液中:c(H+)+c(HF)<c(F- )+2c(OH-) |
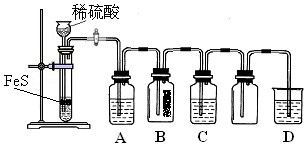 硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中.在人体的很多生理过程中也起着重要作用.
硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中.在人体的很多生理过程中也起着重要作用.| 资料:①H2S可溶于水(约1:2),其水溶液为二元弱酸. ②H2S可与许多金属离子反应生成沉淀. ③H2S在空气中燃烧,火焰呈淡蓝色. |
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为H2S+CuSO4=CuS↓+H2SO4.
②B中的现象是蓝色石蕊试纸变红.
③C中只有浅黄色沉淀产生,且溶液变浅绿色.则C中发生反应的离子方程式为H2S+2Fe3+=S↓+2H++2Fe2+.
④D中盛放的试剂可以是d(填标号).
a.水 b.盐酸 c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
①根据上述实验,可以得出结论:在酸性(或酸性较强)条件下,+4价硫的化合物可以氧化-2价硫的化合物.
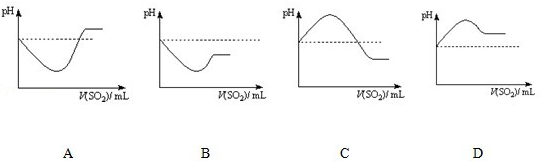
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是C(填序号).
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应.