题目内容
标准状况下,一体积水能溶解700体积氨气,得到密度为0.9g/mL的氨水,计算此氨水的物质的量浓度为 .
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:令氨气为700L,则水为1L,根据n=
计算氨气的物质的量,根据m=nM计算氨气的质量,根据m=ρV计算水的质量,进而计算溶液的质量,根据V=
计算溶液的体积,再根据c=
计算溶液的物质的量浓度.
| V |
| Vm |
| m |
| ρ |
| n |
| V |
解答:
解:令氨气为700L,则水为1L,
氨气的物质的量=
=
mol,氨气的质量=
mol×17g/mol=
g,
水的质量=1L×1000g/L=1000g,
溶液的体积=
=
L,
所得氨水的物质的量浓度=
=18.37mol/L,
故答案为:18.37mol/L.
氨气的物质的量=
| 700L |
| 22.4L/mol |
| 700 |
| 22.4 |
| 700 |
| 22.4 |
| 17×700 |
| 22.4 |
水的质量=1L×1000g/L=1000g,
溶液的体积=
1000g+
| ||
| 900g/L |
| 22400+17×700 |
| 22.4×900 |
所得氨水的物质的量浓度=
| ||
|
故答案为:18.37mol/L.
点评:本题考查物质的量浓度计算,难度不大,侧重对物质的量浓度定义考查.

练习册系列答案
相关题目
用电动公交车初步替代燃油公交车是天津市节能减排、控制雾霾的重要举措之一.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe,有关该电池的下列说法中,正确的是( )
| A、电池反应的化学方程式为:2Li+FeS═Li2S+Fe |
| B、负极的电极反应式为:Al-3e-=Al3+ |
| C、Li-Al在电池中作为负极材料,该材料中Li的化合价是+1 |
| D、电池充电时,阴极反应为:Li2S+Fe-2e-═2Li++FeS |
下列过程需加入还原剂才能实现的是( )
| A、KMnO4→MnO2 |
| B、HSO3-→SO2 |
| C、Cu2+→Cu |
| D、I-→I2 |
常温下,将0.4mol/L的某一元酸HA溶液与0.2mol/L的NaOH溶液等体积混合后(忽略混合前后溶液体积变化),则混合后溶液中的下列关系正确的是( )
| A、可能有c(Na+)>c(A-)>c(HA)>c(OH-)>c(H+) | ||
| B、必定有 c(HA)>c(Na+) | ||
C、可能有c(OH-)=c(H+)+
| ||
| D、c(HA)可能大于0.2mol/L |
 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.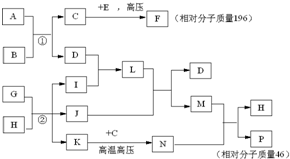 已知C、I、J是常见的气体,A、D是常见的固态非金属单质,E为常见金属,B可用于生产光导纤维,G、H是海水中的主要物质,N是一种盐.在核磁共振氢谱中P有两种峰,F燃烧产生红棕色烟,1molF在真空中完全分解剩余固体的质量是原来的28.6%.试回答下列问题
已知C、I、J是常见的气体,A、D是常见的固态非金属单质,E为常见金属,B可用于生产光导纤维,G、H是海水中的主要物质,N是一种盐.在核磁共振氢谱中P有两种峰,F燃烧产生红棕色烟,1molF在真空中完全分解剩余固体的质量是原来的28.6%.试回答下列问题