题目内容
4.(1)写出离子方程式:①氢氧化钡与硫酸铜反应:Ba2++2OH-+Mg2++SO42-=BaSO4↓+Mg(OH)2↓;
②少量CO2通入澄清石灰水中:CO2+Ca2++2OH-=CaCO3↓+H2O;
(2)配平下列氧化还原反应方程式(若化学计量数为“1”时也要写“1”):
①1Na2S2O3+2HCl→2NaCl+1S+1 SO2↑+1 H2O
②4Zn+10H++1NO3-→4Zn2++1NH4++3H2O
(3)根据下列三个氧化还原反应:
①2FeCl3+2KI═2FeCl2+2KCl+I2 ②2FeCl2+Cl2═2FeCl3
③2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
判断下列Fe3+、Cl2、MnO4-、I2四种粒子的氧化性由强到弱顺序为MnO4->Cl2>Fe3+>I2.
分析 (1)①氢氧化钡与硫酸铜反应反应生成硫酸钡和氢氧化铜沉淀;
②少量CO2通入澄清石灰水中二者反应生成碳酸钙和水;
(2)分析反应中各元素化合价变化,依据氧化还原反应化合价升降数目守恒及原子个数守恒配平方程式;
(3)判断氧化剂和氧化产物,依据同一个氧化还原反应中氧化性:氧化剂>氧化产物.
解答 解:(1)①氢氧化钡与硫酸铜反应反应生成硫酸钡和氢氧化铜沉淀,离子方程式:Ba2++2OH-+Mg2++SO42-=BaSO4↓+Mg(OH)2↓;
②少量CO2通入澄清石灰水中二者反应生成碳酸钙和水,离子方程式:CO2+Ca2++2OH-=CaCO3↓+H2O;
故答案为:Ba2++2OH-+Mg2++SO42-=BaSO4↓+Mg(OH)2↓;CO2+Ca2++2OH-=CaCO3↓+H2O;
(2)①反应中硫代硫酸钠中+2价的硫一半化合价升高为硫单质中0价的硫,一半化合价升高为二氧化硫中+4价的硫,依据氧化还原反应化合价升降数目相等,可知硫单质和二氧化硫系数都是1,依据原子个数守恒反应方程式:1Na2S2O3+2HCl=2NaCl+1S+1SO2↑+1H2O;
故答案为:1;2;2;1;1;1;
②反应中0价的锌化合价升高为+2价的锌离子,硝酸根中+5价氮降为氨根离子中-3价的氮,要使化合价升降数目相等,则锌的系数为4,硝酸根系数为1,依据原子个数守恒反应的方程式:4Zn+10H++1NO3-=4Zn2++1NH4++3H2O;
故答案为:4;10;1;4;1;3;
(3)①2FeCl3+2KI═2FeCl2+2KCl+I2 反应中氯化铁为氧化剂,碘为氧化产物,所以氧化性:Fe3+>I2;
②2FeCl2+Cl2═2FeCl3反应中Cl2为氧化剂,FeCl3为氧化产物,所以氧化性:Cl2>Fe3+;
③2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,反应中氯化铁为氧化剂,碘为氧化产物,所以氧化性:MnO4->Cl2;
所以氧化性强弱顺序为:MnO4->Cl2>Fe3+>I2;
故答案为:MnO4->Cl2>Fe3+>I2.
点评 本题考查了离子方程式的书写、氧化还原反应方程式配平、氧化性强弱的判断,明确反应实质及氧化还原反应规律是解题关键,题目难度中等.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案| A. | 112 mL | B. | 224 mL | C. | 448 mL | D. | 560 mL |
| A. | 0.1mol•L-1的醋酸的pH=a,0.01mol•L-1的醋酸的pH=b,则a+1=b | |
| B. | 用200mL 4mol•L-1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为:3CO2+4OHˉ═CO32ˉ+2HCO3ˉ+H2O | |
| C. | 难溶电解质AB2的饱和溶液中,c(A2+)=xmol•L-1,c(B-)=y mol•L-1,则Ksp值为4xy2 | |
| D. | 常温下0.1mol•L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)=0.1 mol•L-1 |
| A. | 胶体区别于其它分散系的本质特征是分散质的微粒直径在1nm~100nm之间 | |
| B. | 用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体 | |
| D. | 胶体是一种介稳性的分散系,其粒子能通过滤纸 |
| A. | 0.5mol/L NH4Cl溶液 | B. | 0.5mol/L盐酸 | ||
| C. | 0.5mol/LH2SO4 | D. | 0.5mol/L醋酸 |
(1)O2、F2、S、N2;
(2)Fe、Na、Al、Si;
(3)NO、CO2、SO2、CaO.
| 组 别 | 被选出的物质 | 挑选依据 |
| 第(1)组 | ||
| 第(2)组 | ||
| 第(3)组 |
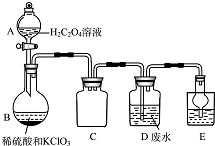 ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:
ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题: