题目内容
4.证明海带中含有碘,有以下步骤:①灼烧海带至完全生成灰,停止加热,冷却;②在滤液中滴加稀H2SO4及H2O2,然后加入几滴淀粉溶液;③用剪刀剪碎海带,用酒精润湿,放入坩埚中; ④海带灰转移到小烧杯,加蒸馏水,搅拌、煮沸、过滤.
(1)合理的步骤顺序是③①④②
(2)证明含碘的步骤是②,现象是滴入淀粉溶液,溶液变蓝,反应的离子方程式是2I?+2H++H2O2=I2+2H2O.
分析 (1)将海带灼烧再溶于水,得到含碘离子的水溶液,在酸性环境下用氧化剂将碘离子氧化为碘单质,进行检验即可;
(2)碘离子能被氧化为碘单质,碘单质遇到淀粉显示蓝色,据此回答.
解答 解:(1)证明海带中含有碘,步骤是:在坩埚中将海带灼烧再溶于水,得到含碘离子的水溶液,在酸性环境下用氧化剂将碘离子氧化为碘单质,根据碘单质遇到淀粉变蓝的现象,检验碘单质的生成,证明含有碘离子,则操作步骤为③①④②;
故答案为:③①④②;
(2)碘离子氧化为碘单质,滴入淀粉溶液,溶液变蓝,则证明含碘,H2O2是绿色氧化剂,可以将碘离子氧化,还原产物是水,即2I-+2H++H2O2=I2+2H2O.
故答案为:②;滴入淀粉溶液,溶液变蓝;2I-+2H++H2O2=I2+2H2O.
点评 本题考查物质的分离、提纯以及物质的检验,侧重于学生的分析、实验能力的考查,涉及过滤操作、氧化还原反应等,为高考常见题型,题目难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
14.现有碳酸钾和碳酸氢钾的混合物样品,为测记其组成,分别称取三份不同质量的该混合物样品,配成溶液,然后用相同浓度的硫酸进行滴定,已知:CO32-”与H+反应生成CO2,分两步:CO32-+H+=HCO3-+H+=CO2↑+H2O
下列说法正确的是( )
| 实验编号 | 1 | 1 | 3 |
| 混合物的体积/g | 3.76 | 4.70 | 8.46 |
| 硫酸浓液的体积/mL | 50.00 | 50.00 | 50.00 |
| 生成一氧化碳的物质的量/mol | 0.03 | 0,0375 | 0.03 |
| A. | 样品中碳酸钾和碳酸氢钾的物成的量之比为1:2 | |
| B. | 样品中碳酸钾和碳酸氢钾的物质的量之比为2:3 | |
| C. | 所用硫酸的物质的量浓度为l.5mol•L-1 | |
| D. | 所用嫌酸的物质的量浓度为0.75mol•L-1 |
12.金刚烷胺是最早用于抑制流感病毒的抗疾病毒药,其合成路线如图所示.下列说法不正确的是( )

| A. | 金刚烷的分子式是C10H16 | |
| B. | X的一种同分异构体是芳香族化合物 | |
| C. | 上述反应都属于取代反应 | |
| D. | 金刚烷胺的一溴代物有四种 |
19.下列化学用语表示正确的是( )
| A. | 甲烷的球棍模型: | B. | 硫离子的结构示意图: | ||
| C. | HF的电子式: | D. | 次氯酸结构式:H-Cl-O |
9.下列化学用语正确的是( )
| A. | CO2的结构式 O=C=O | B. | HCl的电子式 | ||
| C. | 氯离子结构示意图 | D. | 作为相对原子质量标准的原子614C |
16.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构.关于ABCD四种元素的叙述正确的是( )
| A. | 原子序数a>b>c>d | |
| B. | 最高价氧化物对应水化物的碱性B>A | |
| C. | 单质还原性A>B>C>D | |
| D. | 离子半径D(n+1)->Cn->An+>B(n+1)+ |
3.Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色反应呈黄色.五种元素核电荷数之和为54,W、Z最外层电子数相同,Z的核电荷数是W的2倍.工业上一般通过电解氧化物的方法获得Y的单质.则下列说法不正确的是( )
| A. | 原子半径:X>Y>Z>Q>W | |
| B. | 最高价氧化物对应的水化物的酸性:Z<Q | |
| C. | Q和W可形成原子个数比为1:1和2:1的化合物 | |
| D. | X、Y和W三种元素形成的化合物的水溶液呈碱性 |

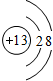 ,MgO的电子式
,MgO的电子式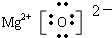 .
.