题目内容
12.金刚烷胺是最早用于抑制流感病毒的抗疾病毒药,其合成路线如图所示.下列说法不正确的是( )
| A. | 金刚烷的分子式是C10H16 | |
| B. | X的一种同分异构体是芳香族化合物 | |
| C. | 上述反应都属于取代反应 | |
| D. | 金刚烷胺的一溴代物有四种 |
分析 A.由结构简式确定分子式;
B.X含有4个环,不饱和对为4;
C.根据官能团的变化判断;
D.金刚烷胺有3种H原子.
解答 解:A.由结构简式可知金刚烷的分子式是C10H16,故A正确;
B.X含有4个环,不饱和对为4,则X的一种同分异构体是芳香族化合物,故B正确;
C.分别为H、Br原子被替代,为取代反应,故C正确;
D.金刚烷胺有3种H原子(氨基除外),则金刚烷胺的一溴代物有三种,故D错误.
故选D.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把握有机物的结构特点以及同分异构体的判断,难度不大.

练习册系列答案
相关题目
2.下列各组有机物只用一种试剂无法鉴别的是( )
| A. | 乙醇、苯酚、硝基苯 | B. | 苯、乙醛、乙烯 | ||
| C. | 甲酸、甲苯、乙酸 | D. | 苯乙烯、乙苯、环己烷 |
3.25℃、101 kPa下:
①2Na(s)+$\frac{1}{2}$O2(g)═Na2O(s)△H1=-414kJ/mol
②2Na(s)+O2(g)═Na2O2(s)△H1=-511kJ/mol
下列说法正确的是( )
①2Na(s)+$\frac{1}{2}$O2(g)═Na2O(s)△H1=-414kJ/mol
②2Na(s)+O2(g)═Na2O2(s)△H1=-511kJ/mol
下列说法正确的是( )
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 25℃、101kPa下Na2O(s)+O2(g)═2Na2O2(s)△H=-142kJ/mol | |
| D. | 25℃、101kPa下Na2O2(s)+2Na(g)═2Na2O(s)△H=-317kJ/mol |
20.FeC13、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断正确的是( )
| A. | 加入KSCN溶液不一定变红色 | B. | 溶液中一定含Cu2+ | ||
| C. | 溶液中一定不含Fe3+ | D. | 剩余固体中一定是Fe |
7.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 含1molFeCl3的饱和溶液滴入沸水中得到胶体数目为NA | |
| B. | 在标准状况下,22.4LCl2和HCl的混合气体中含有的分子总数为2×6.02×1023 | |
| C. | 常温常压下,7.8gNa2S固体和7.8gNa2O2固体中含有的阴离子数目均为0.1NA | |
| D. | 标准状况下,Na2O2与足量的CO2反应生成2.24LO2,转移电子数为0.4NA |
1.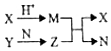 短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
 短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )| A. | 相对分子质量M>N,沸点N>M | B. | 原子半径:D>B>C>A | ||
| C. | Z为Na2CO3 | D. | 图中有两个氧化还原反应 |
2.“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO.某小组在实验室制备NaClO溶液,并进行性质探究和成分测定.
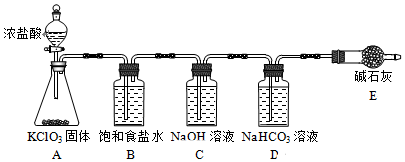
(1)该小组按图装置进行实验,反应一段时间后,分别取B、C、D瓶的溶液进行实验,实验现象如表.(已知饱和NaClO溶液pH为11)
①装置A中反应的化学方程式为KClO3+6HCl=3Cl2↑+KCl+3H2O.
②B瓶溶液中H+的主要来源是氯气中的氯化氢.
③C瓶溶液的溶质是NaClO、NaCl、NaOH(填化学式).
④结合平衡移动原理解释D瓶溶液中石蕊立即褪色的原因溶液中存在平衡Cl2+H2O?HCl+HClO,HCO3-消耗H+,使平衡右移,HClO浓度增大.
(2)测定C瓶溶液中NaClO含量(单位:g•L-1)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶,加足量盐酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应.
Ⅱ.用0.1000mol•L-1 Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00mL Na2S2O3溶液.(I2+2S2O32-═2I-+S4O62-)
①步骤Ⅰ总反应的离子方程式为ClO-+2I-+2H+=I2+Cl-+H2O,盖紧瓶塞并在暗处反应的原因是防止HClO分解.
②C瓶溶液中NaClO的含量为3.7g•L-1.(保留1位小数.NaClO式量为74.5)

(1)该小组按图装置进行实验,反应一段时间后,分别取B、C、D瓶的溶液进行实验,实验现象如表.(已知饱和NaClO溶液pH为11)
| 实验步骤 | 实验现象 | ||
| B瓶 | C瓶 | D瓶 | |
| 实验1:取样,滴加紫色石蕊溶液 | 变红,不褪色 | 变蓝,不褪色 | 立即褪色 |
| 实验2:取样,测定溶液的pH | 3 | 12 | 7 |
②B瓶溶液中H+的主要来源是氯气中的氯化氢.
③C瓶溶液的溶质是NaClO、NaCl、NaOH(填化学式).
④结合平衡移动原理解释D瓶溶液中石蕊立即褪色的原因溶液中存在平衡Cl2+H2O?HCl+HClO,HCO3-消耗H+,使平衡右移,HClO浓度增大.
(2)测定C瓶溶液中NaClO含量(单位:g•L-1)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶,加足量盐酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应.
Ⅱ.用0.1000mol•L-1 Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00mL Na2S2O3溶液.(I2+2S2O32-═2I-+S4O62-)
①步骤Ⅰ总反应的离子方程式为ClO-+2I-+2H+=I2+Cl-+H2O,盖紧瓶塞并在暗处反应的原因是防止HClO分解.
②C瓶溶液中NaClO的含量为3.7g•L-1.(保留1位小数.NaClO式量为74.5)