题目内容
部分弱酸的电离平衡常数如表:下列选项错误的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K1=1.77×10-4 | K1=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A、中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 |
| B、相同温度时,等浓度的HCOONa和NaCN溶液的pH前者小于后者 |
| C、2CN-+H2O+CO2=2HCN+CO32- |
| D、2HCOOH+CO32-=2HCOO-+H2O+CO2↑ |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:弱酸的电离平衡常数越大,其酸性越强,等pH的弱酸溶液,酸性越强的酸其物质的量浓度越小,弱酸根离子水解程度越小,结合强酸能和弱酸盐反应制取弱酸分析解答.
解答:
解:根据电离平衡常数知,酸性强弱顺序为:HCOOH>H2CO3>HCN>HCO3-,
A.等pH的HCOOH和HCN溶液,甲酸的物质的量浓度小于氢氰酸,所以中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故A正确;
B.酸性越强,对应盐的水解程度越小,pH越小,酸性HCOOH>HCN,则水解程度:HCOONa<NaCN,所以等浓度的HCOONa和NaCN溶液的pH前者小于后者,故B正确;
C.氢氰酸的酸性大于碳酸氢根离子而小于碳酸,所以发生CN-+H2O+CO2→HCN+HCO3-反应,故C错误;
D.甲酸的酸性大于碳酸,所以2HCOOH+CO32-→2HCOO-+H2O+CO2↑能发生,故D正确;
故选C.
A.等pH的HCOOH和HCN溶液,甲酸的物质的量浓度小于氢氰酸,所以中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故A正确;
B.酸性越强,对应盐的水解程度越小,pH越小,酸性HCOOH>HCN,则水解程度:HCOONa<NaCN,所以等浓度的HCOONa和NaCN溶液的pH前者小于后者,故B正确;
C.氢氰酸的酸性大于碳酸氢根离子而小于碳酸,所以发生CN-+H2O+CO2→HCN+HCO3-反应,故C错误;
D.甲酸的酸性大于碳酸,所以2HCOOH+CO32-→2HCOO-+H2O+CO2↑能发生,故D正确;
故选C.
点评:本题考查弱电解质的电离,根据平衡常数确定酸性强弱,从而确定酸之间的转化,结合电荷守恒来分析解答,难度中等.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
84消毒液主要成分是( )
| A、NaCl |
| B、NaClO (次氯酸钠) |
| C、Ca(ClO)2 (次氯酸钙) |
| D、CaCl2 |
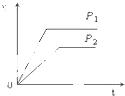
对室温下100mL pH=2的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )


| A、加水稀释至溶液体积为200mL,醋酸溶液的pH变为4 |
| B、温度都升高20°C后,两溶液的pH不再相等 |
| C、加水稀释至溶液体积为200mL后,两种溶液中c(OH-)都减小 |
| D、加足量的锌充分反应后,两溶液中产生的氢气体积可用上图表示 |
向水中分别加入下列溶液,对水的电离平衡不产生影响的是( )
| A、KHSO4溶液 |
| B、KHCO3溶液 |
| C、KHS溶液 |
| D、KI溶液 |
已知25℃下,0.1mol/L某二元酸(H2A)溶液的pH大于1,其酸式盐NaHA溶液的pH<7.取等体积的H2A溶液和NaOH溶液混合后,所得溶液的pH=7,则酸溶液与碱溶液的物质的量浓度之比是( )
| A、小于0.5 |
| B、等于0.5 |
| C、大于1且小于2 |
| D、大于0.5且小于1 |
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、1L1 mol/L的Na2CO3溶液中含有的CO32-数目为NA |
| B、标准状况下,1.8gH2O所含有的质子数、电子数均为NA |
| C、25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
| D、常温常压下,2.24L氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA |
 某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数.
某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数.