题目内容
三氟化硼是平面正三角形因此是非极性分子,推断三氯甲烷(碳原子位于分子结构中心)的结构和分子的极性情况是( )
| A、正四面体,非极性分子 |
| B、平面三角形,非极性分子 |
| C、四面体,极性分子 |
| D、平面三角形,极性分子 |
考点:判断简单分子或离子的构型,极性分子和非极性分子
专题:化学键与晶体结构
分析:根据价层电子对互斥理论确定三氯甲烷的空间构型,该分子中Cl原子和H原子电负性不同,导致C原子和Cl原子、C原子和H原子之间的作用力不同,据此判断分子极性情况.
解答:
解:三氯甲烷中价层电子对个数=4+
×(4-3×1-1×1)=4且不含孤电子对,所以三氯甲烷是四面体构型,该分子中Cl原子和H原子电负性不同,导致C原子和Cl原子、C原子和H原子之间的作用力不同,所以该分子中的正负电荷重心不重合,则为极性分子,故选C.
| 1 |
| 2 |
点评:本题考查了分子空间构型及分子极性的判断,根据价层电子对互斥理论及正负电荷重心是否重合来分析解答,难点是孤电子对个数的计算方法,题目难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
下列说法正确的是( )
| A、H2的热值(单位质量的燃料完全燃烧时所放出的热量,叫做燃料的热值)为142.9kJ?g-1,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ?mol-1 |
| B、反应A(g)═2B(g),若正反应的活化能为Ea kJ?mol-1,逆反应的活化能为Eb kJ?mol-1,则△H=(Ea-Eb)kJ?mol-1 |
| C、能自发进行的化学反应,一定是△H<0、△S>0 |
| D、增大反应物浓度,可增大单位体积内活化分子百分数,从而增加有效碰撞的次数 |
下列说法正确的是( )
| A、苯、乙烯都能因反应而使溴水褪色 |
| B、等质量的甲烷、乙烯、乙炔充分燃烧,消耗氧气的量由少到多 |
C、CH3CH2OH、 、CH3COOH电离出H+的能力由弱到强 、CH3COOH电离出H+的能力由弱到强 |
| D、蔗糖和福尔马林与新制氢氧化铜悬浊液共热,都产生红色沉淀 |
下列反应属于氧化还原反应的是( )
| A、二氧化碳和澄清石灰水反应 |
| B、铝和三氧化二铁高温下反应 |
| C、碳酸氢钠受热分解 |
| D、氧化铜和稀硫酸反应 |
某无色透明溶液能与铝作用放出氢气,此溶液中可能大量共存的离子组是( )
| A、Cl-、SO42-、Cu2+、K+ |
| B、K+、ClO-、Na+、NO3- |
| C、SO42-、Na+、HCO3-、K+ |
| D、NO3-、Ba2+、Cl-、Fe2+ |
下面关于原电池和电解池的说法中正确的是( )
| A、电解池的阳极和原电池的负极上都发生氧化反应 |
| B、化学性质活泼的一极在原电池中一定作负极,在电解池中一定作阴极 |
| C、原电池与电解池都是将电能转化为其他能量形式的装置 |
| D、用惰性电极电解稀硫酸溶液,阴、阳极产物的质量之比为2:1 |
下列变化过程中,原物质分子内共价键被破坏,同时有离子键形成的是( )
| A、盐酸与氢氧化钠溶液反应 |
| B、二氧化碳与过氧化钠反应 |
| C、氯化氢与氨气反应生成氯化铵固体 |
| D、氯化氢溶于水 |
甲、乙、丙三种有机物的结构简式如图所示,下列说法不正确的是( )
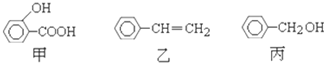

| A、甲、乙、丙都能发生加成反应、取代反应 |
| B、丙与C6H5OH都含有-OH,质谱图显示的质荷比最大值相差14,但不属于同系物 |
| C、淀粉、油脂、有机玻璃等都属于高分子化合物 |
| D、乙的化学名称为苯乙烯,能使溴水褪色,但不存在顺反异构体 |
 某硫酸盐A的两种阳离子由常见的短周期元素组成,将该盐溶于水,向溶液中滴加烧碱溶液,生成沉淀的物质的量与NaOH溶液的体积关系如图所示,下列离子在溶液中能大量共存,加入晶体A后,仍能大量共存的是( )
某硫酸盐A的两种阳离子由常见的短周期元素组成,将该盐溶于水,向溶液中滴加烧碱溶液,生成沉淀的物质的量与NaOH溶液的体积关系如图所示,下列离子在溶液中能大量共存,加入晶体A后,仍能大量共存的是( )| A、Na+、K+、Cl-、OH- |
| B、Mg2+、Fe3+、Br-、HCO3- |
| C、K+、Ba2+、NO3-、I- |
| D、Na+、H+、Cl-、NO3- |