题目内容
17.下列叙述正确的是( )| A. | 甲苯、苯乙烯都既使酸性高锰酸钾褪色,也能使溴水褪色 | |
| B. | 塑料、橡胶和合成纤维都属于有机高分子化合物 | |
| C. | 肥皂是高级脂肪酸与甘油的酯化产物 | |
| D. | 石蜡是从石油中获取的油脂 |
分析 A.甲苯不能使溴水褪色,只萃取;
B.根据有机高分子化合物的定义判断;
C.肥皂的主要成分为高级脂肪酸钠;
D.石蜡为烃类物质.
解答 解:A.甲苯只能萃取溴水中的溴,但没有发生化学反应,如不振荡,则溴水不褪色,故A错误;
B.有机高分子化合物的相对分子质量一般在10000以上,塑料、橡胶和合成纤维都为高聚物,都是高分子化合物,故B正确;
C.肥皂的主要成分为高级脂肪酸钠,故C错误;
D.石蜡为烃类物质,不是油脂,故D错误.
故选B.
点评 本题考查较为综合,涉及有机物的组成、结构、性质以及应用,为高考常见题型和高频考点,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
5.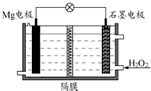 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )
 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )| A. | 电池工作时,石墨周围海水的pH减少 | |
| B. | 电池工作时,溶液中的H+向负极移动 | |
| C. | 电池总反应为Mg+H2O2+2H+═Mg2++2H2O | |
| D. | Mg电极是该电池的正极 |
12.下列物质既能跟NaOH溶液作用,又能跟盐酸反应的是( )
| A. | NaHS | B. | Al2O3 | C. | NaHSO4 | D. | NaAlO2 |
9.如图所示的装置中,在产生电流时,以下说法不正确的是( )
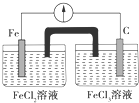

| A. | Fe是负极,C是正极 | B. | 负极反应式:Fe-3e-═Fe3+ | ||
| C. | 内电路中阴离子移向FeCl2溶液 | D. | 电流由石墨电极流向Fe电极 |
6.用锌块与20mL3mol•L-1硫酸反应制取H2,若要增大反应速率,可采取的措施是①再加入20mL同浓度的稀硫酸 ②加入几滴CuSO4溶液 ③改用粉末状锌 ④适当升高温( )
| A. | ①②④ | B. | ②③④ | C. | ①③④⑤ | D. | ①②③④ |
7.下列反应所得溶液中一定只含一种溶质的是( )
| A. | 向铁粉中加入一定量的稀硝酸 | |
| B. | 向MgSO4,H2SO4的混合液中滴入过量Ba(OH)2溶液 | |
| C. | 向NaOH溶液中通入一定量CO2气体 | |
| D. | 将物质的量浓度之比为2:7的AlCl3和NaOH溶液等体积混合 |
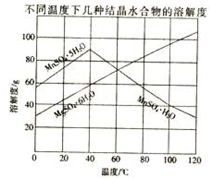 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4 某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.
某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.