题目内容
9.用20mL0.1mol/L的FeSO4溶液,恰好还原1.0×10-3mol[RO(OH)2]+离子,则R元素的最终价态为( )| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
分析 [RO(OH)2]+ 中R的化合价是+5价,该反应中,亚铁离子失电子生成铁离子,R元素得电子发生还原反应,在氧化还原反应中得失电子数相等,根据转移电子守恒进行计算.
解答 解:[RO(OH)2]+ 中R的化合价是+5价,该反应中,亚铁离子失电子生成铁离子,R元素得电子发生还原反应,
设R元素的最终价态为x,
根据转移电子守恒得:0.1mol/L×0.02L×(3-2)=1.0×10-3 mol×(5-x),
0.002mol=1.0×10-3 mol×(5-x),
解得:x=+3,
故选B.
点评 本题考查了氧化还原反应的有关计算,明确氧化还原反应中得失电子相等是解本题关键,根据转移电子守恒来分析解答即可,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.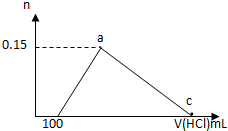 在100mLAlCl3溶液中加入一定量的NaOH溶液,在反应后溶液中逐滴加入1mol/L盐酸,滴入盐酸的体积与产生沉淀的物质的量的关系如图所示,下列叙述正确的是( )
在100mLAlCl3溶液中加入一定量的NaOH溶液,在反应后溶液中逐滴加入1mol/L盐酸,滴入盐酸的体积与产生沉淀的物质的量的关系如图所示,下列叙述正确的是( )
 在100mLAlCl3溶液中加入一定量的NaOH溶液,在反应后溶液中逐滴加入1mol/L盐酸,滴入盐酸的体积与产生沉淀的物质的量的关系如图所示,下列叙述正确的是( )
在100mLAlCl3溶液中加入一定量的NaOH溶液,在反应后溶液中逐滴加入1mol/L盐酸,滴入盐酸的体积与产生沉淀的物质的量的关系如图所示,下列叙述正确的是( )| A. | 原AlCl3溶液的物质的量浓度为1.5mol/L | |
| B. | c点的体积为750mL | |
| C. | 原加入的NaOH的物质的量为0.7mol | |
| D. | a和c点间铝元素以AlO2-和Al(OH)3的形式存在 |
14.化学反应前后必定发生改变的是( )
| A. | 分子种类 | B. | 元素种类 | C. | 原子数目 | D. | 各物质质量总和 |
1.起固定氮作用的化学反应是( )
| A. | N2与H2在一定条件下合成NH3 | B. | NO与O2反应生成NO2 | ||
| C. | NH3被O2氧化成NO和H2O | D. | 由NH3制备化肥NH4HCO3 |
18.下列反应属于氧化还原反应的是( )
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$A12O3+2Fe | ||
| C. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | D. | KCl+Ag NO3═KNO3+AgCl↓ |
 如图1所示,实验室用NH4Cl和Ca(OH)2制取NH3.试回答下列问题:
如图1所示,实验室用NH4Cl和Ca(OH)2制取NH3.试回答下列问题: