题目内容
18.下列反应属于氧化还原反应的是( )| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$A12O3+2Fe | ||
| C. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | D. | KCl+Ag NO3═KNO3+AgCl↓ |
分析 氧化还原反应的实质为电子转移、特征为化合价升降,所以氧化还原反应中一定存在元素化合价变化,据此对各选项进行判断.
解答 解:A.CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑为分解反应,反应中不存在化合价变化,不属于氧化还原反应,故A错误;
B.2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$A12O3+2Fe为置换反应,Al、Fe元素的化合价发生变化,属于氧化还原反应,故B正确;
C.2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO为镁的燃烧反应,存在化合价变化,属于氧化还原反应,故C正确;
D.KCl+Ag NO3═KNO3+AgCl↓为复分解反应,不存在化合价变化,不属于氧化还原反应,故D错误;
故选BC.
点评 本题考查了氧化还原反应的判断,题目难度不大,明确氧化还原反应的实质、特征为解答关键,注意掌握四种基本反应类型与氧化还原反应之间的关系,试题有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
8.配制2mol/L的NaOH的溶液90mL,应选用的容量瓶型号及称取的NaOH固体的质量分别为( )
| A. | 90mL容量瓶,7.2g | B. | 100mL容量瓶,8.0g | ||
| C. | 100mL容量瓶,7.2g | D. | 250mL容量瓶,20.0g |
6.下列溶液中,滴加KSCN溶液颜色变红色的是( )
| A. | 氯化铁溶液 | B. | 氯化亚铁溶液 | C. | 氯化铜溶液 | D. | 硫酸铜溶液 |
13.洗涤试管内壁附着有硫的试管,可使用下列试剂中的( )
| A. | 盐酸 | B. | NaCl | C. | 水 | D. | 二硫化碳 |
3.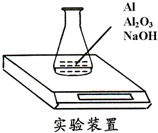 某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:
某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:
(1)反应中产生的氢气质量为0.06g.
(2)求样品中Al的质量分数.(要求有计算过程)
 某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:
某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:| 读数次数 | 质量(g) | |
| 锥形瓶 + NaOH溶液 + 试样 | 第1次 | 188.30 |
| 第2次 | 188.28 | |
| 第3次 | 188.25 | |
| 第4次 | 188.24 | |
| 第5次 | 188.24 |
(2)求样品中Al的质量分数.(要求有计算过程)
10.胶体区别于其他分散系的本质特征是( )
| A. | 胶体是澄清透明的 | B. | 胶体能产生丁达尔现象 | ||
| C. | 分散质粒子直径在1nm~100nm之间 | D. | 胶体在一定条件下能稳定存在 |
7.氢气是人类理想的能源.已知在25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则下列热化学方程式书写正确的是( )
| A. | 2H2+O2═2H2O△H=-142.9 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ/mol |
 请完成下列各题
请完成下列各题