题目内容
18.火山喷发产生的硫磺可用于上产生重要的化工原料硫酸,某企业用如图2所示的工艺流程生产硫酸: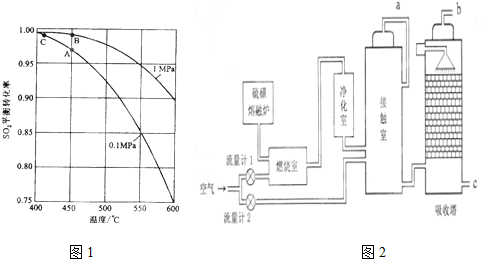
请回答下列问题
(1)硫酸的用途非常广泛,可应用于下列哪些BC(可多选)
A.过磷酸钙的制备
B.表面活性剂“烷基苯硫酸钠”的合成
C.铅蓄电池的生产
(2)为充分利用反应放出的热量,接触室中应安装热交换器(填设备名称)吸收塔中填充有许多瓷管,其作用是增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收
(3)工业对硫酸厂尾气的处理方法一般是用氨水来吸收
(4)如果进入接触室的混合气(含SO2体积分数为7%、O2为11%,N2为82%)中SO2平衡转化率与温度及压强的关系如图1所示,在实际生产中,SO2催化氧反应的条件选择常压和450℃,而没有选择SO2转化率更高的B会C点对应的反应条件,其原因分别是不选B点,压强越大对设备的投资越大,消耗的动能大,SO2的转化率在1个大气压时,已经很高了,再提高压强SO2的转化率提高不大;不选C点,因为C点温度低,SO2的转化率虽然很高,但是催化剂的催化效率降低,450℃时催化剂的催化效率最高,所以选择A点,不选择C点
(5)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为6:5假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为0.39%(空气中氧气的体积分数按0.2计)
分析 (1)A、橡胶硫化所用到的为单质硫;
B、烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应;
C、铅蓄电池中需要用到硫酸和硫酸铅;
(2)充分利用能量,应安装热交换器,吸引塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面;
(3)二氧化硫是酸性氧化物,可用碱性物质氨水来处理;
(4)从温度、压强对SO2的转化率进行分析;
(5)假设SO2的体积为x,经流量计1通入燃烧室的氧气过量50%,则流量计1中通入氧气的体积为1.5x,经流量计2的氧气量为接触室中SO2完全氧化时理论需氧量的2.5倍,则流量计2中通入氧气的体积为2.5×0.5x=1.25x,则流量计1中通入空气的体积为7.5x,流量计2中通入空气的体积为6.25x;燃烧室剩余空气6.5x,接触室剩余空气6.25x-0.5×0.95x=5.775x,剩余SO20.05x,故b管尾气中SO2的体积分数=$\frac{V(S{O}_{2})}{V(总)}$,据此分析解答.
解答 解:(1)A、橡胶硫化所用到的为单质硫,故A错误;
B、烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应,磺化反应就是与硫酸发生的取代反应,故B正确;
C、铅蓄电池中需要用到硫酸作电解质溶液,故C正确;
故选:BC;
(2)充分利用能量,应安装热交换器,吸引塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收,
故答案为:热交换器;增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收;
(3)硫酸工业的尾气中含有二氧化硫,二氧化硫是酸性氧化物,可用碱性物质氨水来处理,故答案为:用氨水来吸收;
(4)由图2可知,不选B点,压强越大对设备的投资越大,消耗的动能大,SO2的转化率在1个大气压时,已经很高了,再提高压强SO2的转化率提高不大;不选C点,因为C点温度低,SO2的转化率虽然很高,但是催化剂的催化效率降低,450℃时催化剂的催化效率最高,所以选择A点,不选择C点;
故答案为:不选B点,压强越大对设备的投资越大,消耗的动能大,SO2的转化率在1个大气压时,已经很高了,再提高压强SO2的转化率提高不大;不选C点,因为C点温度低,SO2的转化率虽然很高,但是催化剂的催化效率降低,450℃时催化剂的催化效率最高,所以选择A点,不选择C点;
(5)燃烧室中的反应为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,假设SO2的体积为x,则流量计1中通入氧气的体积为1.5x,接触室中的反应为2SO2+O2?2SO3,则流量计2中通入氧气的体积为2.5×0.5x=1.25x;流量计1中通入空气的体积为7.5x,流量计2中通入空气的体积为6.25x,故流经流量计1和流量计2的空气体积比应为7.5x:6.25x=6:5;燃烧室剩余空气6.5x,接触室剩余空气6.25x-0.5×0.95x=5.775x,剩余SO20.05x,故b管尾气中SO2的体积分数为$\frac{0.05x}{6.5x+5.775x+0.05x}$×100%=0.39%;
故答案为:6:5;0.39%;
点评 本题是对化学与技术及工业生产的考查,需要学生细读生产工艺图中各物质的变化进行解答,把握氨碱法、制备浓硫酸的工艺流程及设备的作用、发生的化学反应为解答的关键,题目难度中等.

| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 蒸发操作时,不能使蒸发皿中的水分完全蒸干后才停止加热 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| A. | 物质B的转化率增大 | B. | 平衡向正反应方向移动 | ||
| C. | 物质A的体积分数增大 | D. | a+b>m+n |
 自然界中存在大量的金属元素,其 中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.
自然界中存在大量的金属元素,其 中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.(1)请写出Fe的基态原子核外电子排布式1s22s22p63s23p63d64s2或[Ar]3d64s2.
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),其反应是:[Cu(NH3)2]Ac+CO+NH3?[Cu(NH3)3CO]Ac[醋酸羰基三安合铜(I)]△H<0
①C、N、O三种元素的第一电离能由小到大的顺序为C<O<N;
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为4;
③在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子核N原子轨道的杂化类型分别为sp2、sp3;1mol尿素分子中,σ键的数目为7NA.
(4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃.造成两种晶体熔点差距的主要原因是MgO晶体所含离子半径小,电荷数多,晶格能大.
(5)(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾.其中NH4-的空间构型是正四面体(用文字描述),与NO3-互为等电子体的分子是SO3或者BF3.(填化学式)
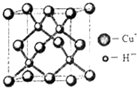
(6)铜的化合物种类很多,如图是氢化亚铜的晶胞结构,已知晶胞的棱长为acm,则氢化亚铜密度的计算式为ρ=$\frac{260}{{a}^{3}•{N}_{A}}$g/cm3.(用NA表示阿佛加德罗常数)
| A. | HCl | B. | H2O | C. | H2O2 | D. | C2H2 |
(1)中学化学中利用物质与浓硫酸共热可制备SO2气体,写出用浓硫酸还可制备不同类别的气体的名称:乙烯(写一种).
(2)某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用下图所示装置进行有关实验.
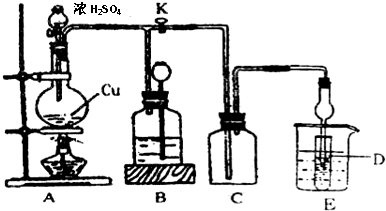
①装置B的作用是贮存多余的气体.B中应放置的液体是d(填序号).
a.饱和Na2SO3溶液 b.酸性 KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
②反应完毕后,烧瓶中还有一定量的余酸,使用足量的下列药品不能用来证明反应结束后的烧瓶中的确有余酸的是b(填序号).
a.Fe粉b.BaCl2溶液 c.CuO d.Na2CO3溶液
③实验中某学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,该反应的化学方程式是2Cu+2H2SO4+O2=2CuSO4+2H2O.
④为验证二氧化硫的还原性,C中盛有氯水,充分反应后,取C中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是Ⅲ(填“I”、“Ⅱ”或“Ⅲ”);C中发生反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-.D中盛有氢氧化钠溶液,当通入二氧化硫至试管D中溶液显中性时,该溶液中c(Na+)=2 c(SO32-)+c(HSO3-)(用含硫微粒浓度的代数式表示).
(3)利用FeCl3溶液的氧化性也可以吸收SO2.
①该反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.检验FeCl3是否完全被还原的方法为取少量反应后的溶液滴加少量硫氰化钾溶液,若不变红则氯化铁完全被还原.
②为验证FeCl3溶液与SO2的反应:同学们将SO2通入0.05mol•L-1 FeCl3溶液中,溶液很快由黄色变为红褐色; 将溶液长时间放置后,最终变为浅绿色. 关于红褐色液体,以下是同学们的分析推测及实验.
| 分析推测 | 实验步骤及现象 |
| 甲:生成了Fe(OH) 3胶体 乙:经查阅资料,可能发生反应:Fe3++6SO2?Fe(SO2)63+ (反应b) | ⅰ.制备Fe(OH) 3胶体并检验 ⅱ.分别向Fe(OH) 3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
根据反应b,说明步骤ⅱ中液体颜色变化的原因是加入铁粉时发生反应2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应Fe3++6SO2?Fe(SO2)63+ 逆向移动(用离子方程式结合必要的文字说明).
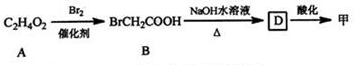
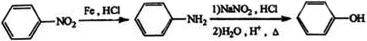
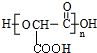 +(n-1)H2O.
+(n-1)H2O.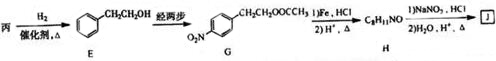
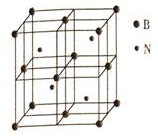 氮族元素的单质及其化合物在农药、化肥等方面有重要应用.我们可以利用物质结构与性质的相关知识去认识和利用它们,
氮族元素的单质及其化合物在农药、化肥等方面有重要应用.我们可以利用物质结构与性质的相关知识去认识和利用它们,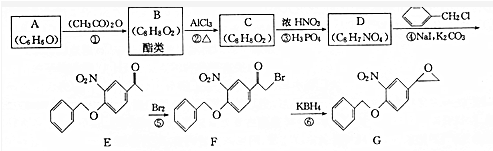
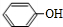 +(CH3CO)2O→
+(CH3CO)2O→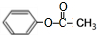 +CH3COOH.
+CH3COOH.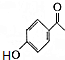 ;D的结构简式为
;D的结构简式为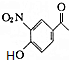 .
.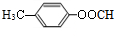 (填结构简式)
(填结构简式)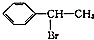 为起始原料制备
为起始原料制备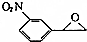 的合成路线:
的合成路线: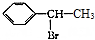 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$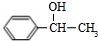 $→_{Cu/△}^{O_{2}}$
$→_{Cu/△}^{O_{2}}$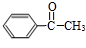 $→_{H_{3}PO_{4}}^{浓HNO_{3}}$
$→_{H_{3}PO_{4}}^{浓HNO_{3}}$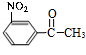 $\stackrel{NaBH_{4}}{→}$
$\stackrel{NaBH_{4}}{→}$