题目内容
9.在一密闭容器中,反应aA(g)+bB(g)?mC(s)+nD(g)达到平衡后,保持温度不变,将容器体积减小为原来体积的$\frac{1}{2}$,达到新的平衡时,D的浓度是原来的1.7倍,下列说法正确的是( )| A. | 物质B的转化率增大 | B. | 平衡向正反应方向移动 | ||
| C. | 物质A的体积分数增大 | D. | a+b>m+n |
分析 保持温度不变,若将容器体积缩小一半,假设平衡不移动,A、B、C、D的浓度应均是原来的2倍,而实际上当达到新的平衡时,D的浓度是原来的1.7倍,说明增大压强平衡逆反应方向移动,则说明a+b<m+n,据此结合外界条件对化学平衡的影响分析.
解答 解:保持温度不变,若将容器体积缩小一半,假设平衡不移动,A、B、C、D的浓度应均是原来的2倍,而实际上当达到新的平衡时,D的浓度是原来的1.7倍,说明增大压强平衡逆反应方向移动,则说明a+b<m+n,
A.平衡逆反应方向移动,则B的转化率降低,故A错误;
B.由分析可知,平衡逆反应方向移动,故B错误;
C.平衡逆反应方向移动,A的体积分数增大,故C正确;
D.增大压强平衡逆反应方向移动,逆向是气体体积减小的反应,则说明a+b<m+n,故D错误;
故选C.
点评 本题考查化学平衡及其影响,题目难度中等,通过改变体积后浓度的变化判断平衡移动的方向为解答关键,注意掌握外界条件对化学平衡的影响,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
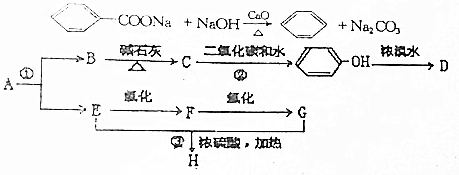
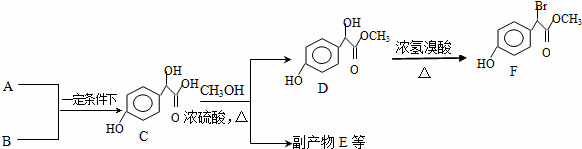
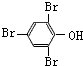 ;化合物H的名称甲酸甲酯.
;化合物H的名称甲酸甲酯.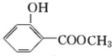 ,
,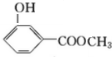 .
.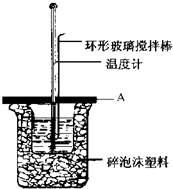 如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是减少热量损失; 若实验中不加盖泡沫塑料板,则求得的中和热数值(填偏大、偏小、无影响).
如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是减少热量损失; 若实验中不加盖泡沫塑料板,则求得的中和热数值(填偏大、偏小、无影响).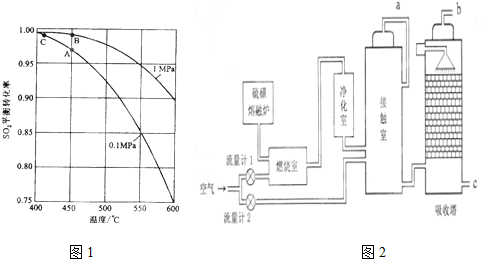
 .
.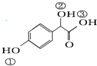 )中①、②、③(从左到右编号)3个-OH的酸性由弱到强的顺序是:③>①>②.
)中①、②、③(从左到右编号)3个-OH的酸性由弱到强的顺序是:③>①>②.