题目内容
6.用铜屑制取硫酸铜溶液的一种方法是:将铜屑放入一定浓度的硫酸中,加热并不断鼓入空气,其反应原理为2Cu+O2+2H2SO4═2CuSO4+2H2O.其中,还原剂是Cu(填化学式),被还原的物质是O2(填化学式),若制备时用2mol Cu与足量的O2和H2SO4反应,可制得2mol CuSO4.分析 反应2Cu+O2+2H2SO4═2CuSO4+2H2O中Cu的化合价升高,在反应中被氧化,做还原剂,氧气化合价降低被还原,在反应中做氧化剂;根据反应方程式计算2mol铜完全反应生成硫酸铜的物质的量.
解答 解:氧化还原反应为2Cu+O2+2H2SO4═2CuSO4+2H2O中,Cu的化合价从0变为+2,化合价升高被氧化,作还原剂;O2的化合价从0变为-2,化合价降低被还原;
根据反应方程式可知,2mol Cu与足量的O2和H2SO4反应,可制得2mol CuSO4,
故答案为:Cu;O2;2.
点评 本题考查了氧化还原反应,题目难度不大,明确氧化还原反应中化合价变化及氧化剂、还原剂、氧化产物、还原产物的概念为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.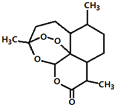 我国科学家屠呦呦获2015年诺贝尔生理学或医学奖.她研究得到的青蒿素挽救了数百万疟疾病人的生命,有关青蒿素说法不合理的是( )
我国科学家屠呦呦获2015年诺贝尔生理学或医学奖.她研究得到的青蒿素挽救了数百万疟疾病人的生命,有关青蒿素说法不合理的是( )
 我国科学家屠呦呦获2015年诺贝尔生理学或医学奖.她研究得到的青蒿素挽救了数百万疟疾病人的生命,有关青蒿素说法不合理的是( )
我国科学家屠呦呦获2015年诺贝尔生理学或医学奖.她研究得到的青蒿素挽救了数百万疟疾病人的生命,有关青蒿素说法不合理的是( )| A. | 化学式为C15H22O5 | |
| B. | 能发生取代反应和氧化反应 | |
| C. | 在H2SO4或 NaOH溶液中均不能稳定存在 | |
| D. | 可用乙醇从青蒿浸取液中萃取出青蒿素 |
14.下列物质的变化,不能通过一步化学反应完成的是( )
| A. | N2→NH3 | B. | SiO2→Na2SiO3 | C. | Na2O2→Na2CO3 | D. | SiO2→H2SiO3 |
1.下列解释事实的方程式不正确的是( )
| A. | 三氧化硫溶于水,溶液显酸性:SO3+H2O═H2SO3 | |
| B. | 用稀硫酸除去铁表面的铁锈:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 漂白粉在空气中放置变质:Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO | |
| D. | 用盐酸除铜锈[Cu2(OH)2CO3]:Cu2(OH)2CO3+4H+═2Cu2++3H2O+CO2↑ |
11.下列关于钠的说法中不正确的是( )
| A. | 金属钠和氧气反应,条件不同,产物则不同 | |
| B. | 将钠投入氯化铵溶液中会有无色有刺激性气味的气体生成 | |
| C. | 当钠与硫酸铜溶液反应时,有大量红色固体铜生成 | |
| D. | 钠的化学性质比较活泼,少量的钠可以保存煤油中 |
18.下列有关说法错误的是( )
| A. | 清晨在树林中有可能观察到丁达尔效应 | |
| B. | 一般情况下溶液中的溶质不会自动与溶剂分离 | |
| C. | 分散质粒子直径在1×10-7~1×10-5cm的分散系叫做胶体 | |
| D. | 饱和抓化铁溶液加热煮沸可制得Fe(OH)3胶体 |
15.实验室中可用如下反应制取氯气:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应中氧化剂与还原剂的物质的量之比为( )
| A. | 1:8 | B. | 5:2 | C. | 1:5 | D. | 5:1 |