题目内容
19.下列离子或分子能够在指定的分散系中大量共存的是( )| A. | 空气中:SO2、NO、N2、NH3 | |
| B. | 0.1mol/L的NaNO3溶液中:K+、I-、Cl-、SO42- | |
| C. | 铁与稀硫酸反应后的溶液中:[Fe(CN)6]3-、NH4+、Cl-、NO3- | |
| D. | 与铝反应生成大量氢气的溶液中:Mg2+、K+、HCO3-、NO3- |
分析 A.一氧化氮气体能够与空气中的氧气反应;
B.NO3-只在酸性条件下具有强氧化性;
C.与Fe2+反应的离子不能大量共存;
D.与铝反应生成大量氢气的溶液可能呈酸性,也可能呈碱性.
解答 解:A.空气中含有氧气,NO能够与氧气反应生成二氧化氮气体,新鲜空气中不会存在一氧化氮气体,故A错误;
B.NO3-只在酸性条件下具有强氧化性,如不是酸性,则氧化性较弱,离子之间不发生任何反应,可大量共存,故B正确;
C.[Fe(CN)6]3-与Fe2+反应而不能大量共存,故C错误;
D.与铝反应生成大量氢气的溶液可能呈酸性,也可能呈碱性,无论呈酸性还是碱性,HCO3-离子都不能大量共存,故D错误.
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,选项C为解答的难点,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
9.用一种试剂把Na2CO3、NaCl、AlCl3、NH4NO3四种溶液区分开,这种试剂是( )
| A. | Ba(OH)2 溶液 | B. | NaOH溶液 | C. | BaCl2溶液 | D. | AgNO3溶液 |
10.只含SiO2杂质的CaCO3样品,在高温煅烧后,残余物为一纯净物,则原样品中SiO2的质量分数是( )
| A. | 40% | B. | 28.6% | C. | 37.5% | D. | 62.5% |
7.下列物质的主要成分和光导纤维的成分不同的是( )
| A. | 水晶 | B. | 玛瑙 | C. | 石英 | D. | 计算机芯片 |
14.关于SO2的说法有:
①SO2是一种大气污染物;
②SO2和Cl2都有漂白作用,且这两种物质的漂白原理相同;
③工业上可用潮湿的石灰石粉末吸收SO2;
④SO2溶于水得硫酸,SO2是一种酸性氧化物;
⑤SO2是硫及某些含硫化合物在空气中燃烧的产物;
⑥SO2可以使酸性高锰酸钾溶液褪色,因为SO2具有漂白作用.
其中正确的是( )
①SO2是一种大气污染物;
②SO2和Cl2都有漂白作用,且这两种物质的漂白原理相同;
③工业上可用潮湿的石灰石粉末吸收SO2;
④SO2溶于水得硫酸,SO2是一种酸性氧化物;
⑤SO2是硫及某些含硫化合物在空气中燃烧的产物;
⑥SO2可以使酸性高锰酸钾溶液褪色,因为SO2具有漂白作用.
其中正确的是( )
| A. | ①②⑤ | B. | ①③④⑤ | C. | ①③⑤ | D. | ①③⑤⑥ |
4.下列关于物质性质的说法不正确的是( )
| A. | HCl气体能使湿润的蓝色石蕊试纸变红 | |
| B. | 通常状况下,NO2是无色的气体 | |
| C. | 铝单质可与氢氧化钠溶液反应生成氢气 | |
| D. | 铁单质与浓硝酸加热时能发生反应 |
11.下列氧化物既能跟稀硫酸反应又能跟氢氧化钠溶液反应的是( )
| A. | Fe2O3 | B. | CO2 | C. | Al2O3 | D. | MnO2 |
8.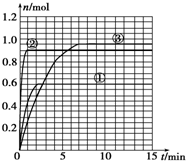 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.
(1)体系中发生反应的化学方程式是2X+2Y?2Z+W;
(2)列式计算该反应在0~3min时间内产物W的平均反应速率:0.042 mol/(L•min);
(3)该反应达到平衡时反应物Y的转化率α等于90%;
(4)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图所示)则曲线①、②、③所对应改变的实验条件分别是:①升高温度;②加入催化剂;③增大压强.
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.| t/min | X/mol | Y/mol | Z/mol | W/mol |
| 0 | 2.00 | 1.00 | 0.00 | 0.00 |
| 1 | 1.80 | 0.80 | 0.20 | 0.10 |
| 3 | 1.50 | 0.50 | 0.50 | 0.25 |
| 5 | 1.30 | 0.30 | 0.70 | 0.35 |
| 9 | 1.10 | 0.10 | 0.90 | 0.45 |
| 10 | 1.10 | 0.10 | 0.90 | 0.45 |
| 14 | 1.10 | 0.10 | 0.90 | 0.45 |
(2)列式计算该反应在0~3min时间内产物W的平均反应速率:0.042 mol/(L•min);
(3)该反应达到平衡时反应物Y的转化率α等于90%;
(4)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图所示)则曲线①、②、③所对应改变的实验条件分别是:①升高温度;②加入催化剂;③增大压强.
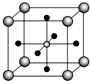 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.