题目内容
9.用一种试剂把Na2CO3、NaCl、AlCl3、NH4NO3四种溶液区分开,这种试剂是( )| A. | Ba(OH)2 溶液 | B. | NaOH溶液 | C. | BaCl2溶液 | D. | AgNO3溶液 |
分析 可用酸或碱鉴别Na2CO3,加入酸生成二氧化碳气体,加入碱应生成沉淀,NH4NO3可与碱反应生成氨气,AlCl3可与碱反应生成氢氧化铝沉淀,碱过量,氢氧化铝溶解,以此解答该题.
解答 解:A.加入氢氧化钡,Na2CO3、NaCl、AlCl3、NH4NO3现象分别为生成沉淀、无现象、先生成沉淀,后溶解、生成刺激性气味的气体,可鉴别,故A正确;
B.加入氢氧化钠,不能鉴别Na2CO3、NaCl,故B错误;
C.加入氯化钡溶液,不能鉴别NaCl、AlCl3、NH4NO3,都不反应,故C错误;
D.加入硝酸银溶液,Na2CO3、NaCl、AlCl3都生成沉淀,不能鉴别,故D错误.
故选A.
点评 本题考查物质的检验和鉴别,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握物质的性质的异同,鉴别时必须有明显的不同现象,难度不大.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
19.下列有关说法中正确的是( )
| A. | 一定温度下,在恒容密闭容器中充入等体积的X、Y气体,发生反应X(g)+Y(g)?2Z(g),一段时间后达到平衡,其他条件不变,再充入0.3mol Z,平衡时Y的体积分数增大 | |
| B. | 碱性锌锰干电池工作过程中,每通过2mol电子,负极质量减轻130g | |
| C. | 通过测定CH3COONa溶液和NaHS溶液的pH,可以比较醋酸和氢硫酸酸性的强弱 | |
| D. | 将MgCl2、Mg(OH)2、MgCO3三种物质与水混合,加热、灼烧,最终的固体产物相同 |
20.元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示.下列说法错误的是( )

| A. | 晶体中每个Xn+周围有2个等距离且最近的N3- | |
| B. | Xn+中n=l | |
| C. | 该晶体中阳离子与阴离子个数比为3:1 | |
| D. | X元素的原子序数是19 |
17.下列溶液中,c(Cl-)与50mL 1mol/L AlCl3溶液中c(Cl- )相等的是( )
| A. | 150mL 1mol/L 的NaCl溶液 | B. | 75mL 2mol/L的NH4Cl溶液 | ||
| C. | 100mL 1.5mol/L的KCl溶液 | D. | 75mL 1mol/L的FeCl3溶液 |
4.如图是原电池的示意图,下列说法正确的是( )


| A. | 铜片逐渐溶解 | B. | 电子由铜片通过导线流向锌 | ||
| C. | 锌片作为正极 | D. | 该装置能将化学能转化为电能 |
14.已知298K,1.01×105Pa条件下:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1;CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.9kJ•mol-1则该条件下CO(g)+H2O(g)═H2(g)+CO2(g)的反应热是( )
| A. | -41.1 kJ•mol-1 | B. | +200.7 kJ•mol-1 | C. | -766.5 kJ•mol-1 | D. | +41.1 kJ•mol-1 |
18.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法中,正确的是( )
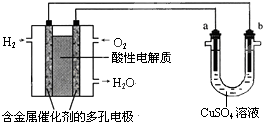

| A. | 燃料电池工作时,正极反应为:O2+4H+-4e-═2H2O | |
| B. | a极是粗铜,b极是纯铜,CuSO4溶液作电解质溶液时,CuSO4溶液浓度保持不变 | |
| C. | a、b两极均是石墨,CuSO4溶液作电解质溶液时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 | |
| D. | a极是铜,b极是铁,NaCl溶液作电解质溶液时铁受到保护,腐蚀速率减慢 |
19.下列离子或分子能够在指定的分散系中大量共存的是( )
| A. | 空气中:SO2、NO、N2、NH3 | |
| B. | 0.1mol/L的NaNO3溶液中:K+、I-、Cl-、SO42- | |
| C. | 铁与稀硫酸反应后的溶液中:[Fe(CN)6]3-、NH4+、Cl-、NO3- | |
| D. | 与铝反应生成大量氢气的溶液中:Mg2+、K+、HCO3-、NO3- |
 有图所示装置,装置A是氢氧燃料电池,已知该装置工作时电子从b极流向Fe电极.
有图所示装置,装置A是氢氧燃料电池,已知该装置工作时电子从b极流向Fe电极.