题目内容
1. 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 若Z是稀硫酸,X为铜,Y为铁,则铁不溶解,该方法为外加电流的阴极保护法 |
分析 A、氯碱工业上,用惰性电极电解饱和氯化钠溶液,阳极上析出氯气,阴极上析出氢气,阴极附近得到氢氧化钠;
B、铜的精炼中,粗铜作阳极,纯铜作阴极,硫酸铜溶液作电解质溶液;
C、电镀工业上,镀层作阳极,镀件作阴极;
D、外加电流的阴极保护法中,阴极是待保护金属.
解答 解:A、氯碱工业上,用惰性电极电解饱和氯化钠溶液,阴极附近得到氢氧化钠,即Y附近能得到氢氧化钠,故A错误;
B、铜的精炼中,粗铜作阳极X,纯铜作阴极Y,硫酸铜溶液作电解质溶液,故B错误;
C、电镀工业上,Y是待镀金属,X是镀层金属,故C错误;
D、外加电流的阴极保护法中,阴极是待保护金属,即Y铁是待保护金属不溶解,故D正确.
故选D.
点评 本题考查了电解原理,根据电解时离子的放电顺序、电镀、电解精炼、金属的腐蚀与防护来分析解答即可,难度不大,注意原电池原理和电解池原理是高考的热点,应掌握此知识点.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
11.下列反应的离子方程式错误的是( )
| A. | 大理石溶于醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 在氯化铝溶液中滴加过量的氨水:Al3++3NH3•H2O═Al (OH)3↓+3NH4+ | |
| C. | 硫氢化钠水解:HS-+H2O?H2S+OH- | |
| D. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+═2Fe3++2H2O |
12.下列变化中必须加入氧化剂才能实现的是( )
| A. | MnO4-→Mn2+ | B. | KClO3→O2 | C. | HCl→Cl2 | D. | Fe3+→Fe2+ |
9.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,2.24L SO3中含有的SO3分子数为0.1NA | |
| B. | 5.6 g Fe与标准状况下2.24L的Cl2充分反应,转移的电子数为0.3NA | |
| C. | 将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na+的浓度为2mol/L | |
| D. | 1molMnO2与4mol浓盐酸充分反应后生成的Cl2分子数为NA |
16.下列配制溶液的操作中,不会影响所配溶液浓度大小的是…( )
| A. | 托盘两边各垫一张质量相等的纸片称取固体NaOH | |
| B. | 容量瓶内水分未干便注入了液体 | |
| C. | 洗涤刚才盛过溶质的烧杯的洗涤液没有转入容量瓶 | |
| D. | 定容后使溶液混匀,静止,发现凹液面低于刻度线,立即滴加蒸馏水至刻度线 |
6.现有三组溶液,①碘水中提取单质碘 ②碘和四氯化碳的混合物 ③汽油和氯化钠溶液,分离以上混合物的正确方法依次是( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
19.氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
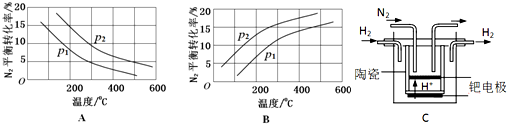
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1(填“>”、“<”或“=”).
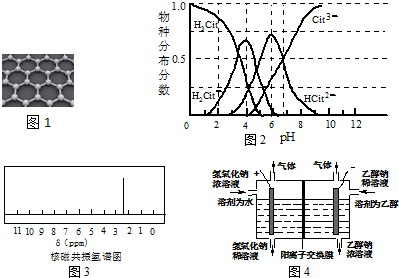
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1(填“>”、“<”或“=”).

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
 .
.