题目内容
4.某小组用如图装置(其它仪器略)电解食盐水,通过测定产物的量计算食盐水的电解率. 食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%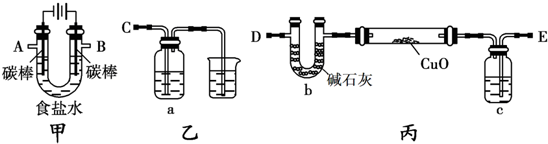
[甲方案]:利用甲、乙装置测定食盐水的电解率.
(1)电解食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+2H2↑+2OH-;若甲中滴有酚酞,则电解时甲中左边(填“左”或“右”)碳棒附近溶液变红.
(2)若a中盛足量NaOH溶液,测定a在电解前后质量变化计算食盐水的电解率,正确连接顺序为B连C(填A、B、C、D、E导管口),a中的化学方程式为Cl2+2NaOH=H2O+NaCl+NaClO.
[乙方案]:利用甲、丙装置测定食盐水的电解率.
(3)若将A接E,通过测定丙中b装置或氧化铜硬质玻璃管反应前后质量差计算食盐水的电解率,则c中应该盛的试剂是浓硫酸.某同学认为该方案测得的实验结果不准确,你认为其可能的原因是氢气还原氧化铜时,氢气不能全部反应,误差太大.
[丙方案]:只利用甲装置测定食盐水的电解率.
(4)常温时,称取58.5gNaCl溶于水配成200mL溶液,置于甲中电解一段时间,所得溶液pH为14,则食盐水的电解率为20.0%(电解前后溶液体积不变,Na-23、Cl-35.5).
分析 (1)甲装置电解饱和食盐水,左侧碳棒连接电源负极,为阴极,右侧碳棒连接电源正极,为阳极,溶液中氯离子在阳极上失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大,遇到酚酞溶液变红色;
(2)甲装置中B口导出的气体为氯气,用氢氧化钠溶液吸收氯气,反应生成氯化钠、次氯酸钠与水;
(3)通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率,是利用U形管测定氢气还原氧化铜过程中生成的水蒸气,要防止外界空气中的水蒸气等被U形管中碱石灰吸收,结合氢气还原氧化铜时,氢气不能全部反应来考虑;
(4)根据溶液pH计算氢氧根离子浓度,结合化学方程式计算反应的氯化钠质量,计算200ml溶液中氯化钠的质量,用反应的氯化钠质量除以原溶液中氯化钠质量得到食盐水的电解率.
解答 解:(1)甲装置电解饱和食盐水,左侧碳棒连接电源负极,为阴极,右侧碳棒连接电源正极,为阳极,溶液中氯离子在阳极上失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大,遇到酚酞溶液变红色,电解氯化钠的总反应为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+2H2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+2H2↑+2OH-;左;
(2)甲装置中B口导出的气体为氯气,用氢氧化钠溶液吸收氯气,则装置B连C,反应生成氯化钠、次氯酸钠与水,离子方程式为:Cl2+2OH-=H2O+Cl-+ClO-,
故答案为:B;C;Cl2+2NaOH=H2O+NaCl+NaClO;
(3)利用甲、丙装置测定饱和食盐水的电解率,通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率,是利用U形管测定氢气还原氧化铜过程中生成的水蒸气,装置中添加一干燥装置防止外界空气中的水蒸气的干扰,c中应该盛的试剂是浓硫酸,氢气还原氧化铜时,氢气不能全部反应,所以该方案测得的实验结果不准确,故答案为:浓硫酸;氢气还原氧化铜时,氢气不能全部反应,误差太大;
(4)若电解200mL饱和食盐水一段时间,测得溶液的为pH为14,则c(H+)=10-14mol/L,c(OH-)=1mol/L,氢氧根离子物质的量=0.2L×1mol/L=0.2mol,由2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑可知,电解的氯化钠物质的量为0.2mol,其质量=0.2mol×58.5g/mol=11.7g,$\frac{11.7g}{58.5g}$×100%=20%,
故答案为:20%.
点评 本题考查电解原理应用、定量测定实验、对装置的分析评价等,关键是对实验原理的理解,侧重考查学生对基础知识的迁移应用,题目难度中等.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
(1)甲、乙两组实验中,哪一组盐酸是不足量的?乙(填“甲”或“乙”).理由是因甲反应后的溶液中再加合金还能继续反应,说明甲中盐酸有剩余,若乙中盐酸恰好完全反应或有剩余,则产生的氢气应为$\frac{385}{255}$×280mL=423mL>336mL,故说明乙中盐酸不足.
(2)要算出盐酸的物质的量浓度,题中可作为计算依据的数据是乙或丙,求得的盐酸的物质的量浓度为1.5mol/L.
(3)求合金中Mg、Al的物质的量之比,题中可作为计算依据的数据是甲,求得的Mg、Al物质的量之比为1:1.
| A. | NH320ml、NO240ml、N240ml | B. | NH3 20ml、NO32ml、CO248ml | ||
| C. | NH320ml、NO20ml、CO260ml | D. | NH320ml、CO228ml、NO52ml |
| A. | 气体的平均分子量不再变化 | B. | 反应的平衡常数不变 | ||
| C. | ?(H2)=2 ?(HI) | D. | 气体的颜色不再变化 |
| A. | 5.6LN2(标准状况)和11gCO2 | B. | 10gH2和10gO2 | ||
| C. | 9gH2O 和0.5molBr2 | D. | 22.4mlH2 (标准状况)和0.1molN2 |
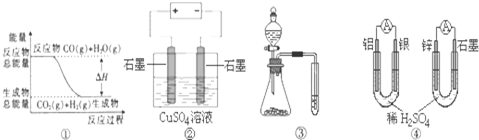
| A. | 图①表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”中的△H大于0 | |
| B. | 图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1:1 | |
| C. | 图③实验装置可完成比较磷酸、碳酸、苯酚的酸性强弱的实验 | |
| D. | 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
| A. | 纯碱溶液能清洗油污:CO32-+2H2O═H2CO3+2OH- | |
| B. | 铜与浓硫酸共热产生气体:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2↑ | |
| C. | 铁钉在潮湿的空气中很快被腐蚀:Fe-3e-═Fe3+ | |
| D. | 氨气遇到氯化氢时产生白烟:NH3+HCl═NH4Cl |
(1)NaHCO3俗称小苏打,其水溶液显碱性的原因是(用离子方程式表示)HCO3-+H2O?H2CO3+OH-.
(2)工业上制备NaHCO3的方法是:先向饱和食盐水通入足量的NH3,再通入过量的CO2得到NaHCO3沉淀,写出该反应的化学方程式NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl.
(3)泡沫灭火器内含一定浓度的NaHCO3(置于铁桶内)和Al2(SO4)3溶液(置于玻璃瓶内)以及起泡剂,使用时把灭火器倒置即有泡沫状物质喷出.
①倒置灭火器时发生反应的离子方程式是Al3++3HCO3-=Al(OH)3↓+3CO2↑;
②有人认为Na2CO3价格便宜,建议用等物质的量浓度、等体积的Na2CO3溶液代替NaHCO3溶液.你认为此建议不合理(填“合理”或“不合理”),理由是等浓度、等体积的NaHCO3与Na2CO3相比,和Al2(SO4)3溶液反应时,NaHCO3生成的CO2既快又多.
(4)由NaHCO3和KHCO3组成的混合物,与50mL等浓度的盐酸分别反应,测得如下数据:
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
②所用盐酸的物质的量浓度是3mol•L-1.
| A. | 化学反应速率是化学反应进行快慢程度的物理量 | |
| B. | 化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示 | |
| C. | 在同一个反应中,可以用反应物或生成物来表示反应速率 | |
| D. | 化学反应速率的常用单位有mol/(L•s)和mol/(L•min) |