题目内容
3.下列说法中,正确的是( )| A. | 乙烷、乙烯、乙炔都难溶于水,且密度比水小 | |
| B. | 可用溴水来鉴别乙烷、乙烯和乙炔三种无色气体 | |
| C. | 在一定条件下,乙烷、乙烯、乙炔都能与氯气发生同类型反应 | |
| D. | 乙烷、乙烯、乙炔都能发生加聚反应生成高分子化合物 |
分析 A、烃类均难溶于水;
B、乙烯和乙炔均能和溴水发生加成反应;
C、乙烷是烷烃,而乙烯和乙炔均是不饱和烃;
D、乙烷中无不饱和键.
解答 解:A、烃类均难溶于水,且均为气体,故密度均比水小,故A正确;
B、乙烯和乙炔均能和溴水发生加成反应,故均能使溴水褪色,故用溴水鉴别不开,故B错误;
C、乙烷是烷烃,而乙烯和乙炔均是不饱和烃,故乙烷和氯气发生的是取代反应,而乙烯和乙炔和氯气发生的是加成反应,故C错误;
D、乙烷中无不饱和键,故不能发生加聚反应,而乙烯和乙炔均可以,故D错误.
故选A.
点评 本题依托乙烷、乙烯和乙炔考查了烷烃、烯烃和炔烃性质的不同点,难度不大,应注意的是烯烃和炔烃在化学性质上有相似之处.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列有关化学反应速率的说法中,正确的是( )
| A. | 实验事制氢气时,加入少量NaNO3固体,不影响反应速率 | |
| B. | 锌片分别与等pH的醋酸、硫酸反应,平均反应速率相等 | |
| C. | 升高温度后,吸热反应的速率加快,放热反应的速率减慢 | |
| D. | 纳米铁粉在空气中自燃,是因为纳米铁粉的表面积大 |
10.将表面有氧化膜的铝片伸入足量的NaOH溶液中,有关离子方程式正确的是( )
| A. | Al2O3+OH-→AlO2-+H2O | B. | 2Al3++6OH-→2Al(OH)3↓ | ||
| C. | 2Al+2OH-+2H2O→2AlO2-+3H2↑ | D. | 2Al+6H2O→2Al3++6OH-+3H2↑ |
11.N4O6是一种新型的火箭推进剂中的氧化剂,燃烧时发生反应N4O6+3N2H4═5N2+6H2O,下列说法正确的是( )
| A. | N4O6的摩尔质量是152 | |
| B. | 该反应为复分解反应 | |
| C. | N4O6为离子化合物 | |
| D. | 该反应中生成标准状况下11.2L N2,转移的电子数为1.2NA |
18.某同学将金属钠露置于空气中,观察到下列现象:银白色$\stackrel{①}{→}$变灰暗$\stackrel{②}{→}$变白色$\stackrel{③}{→}$出现液滴$\stackrel{④}{→}$白色晶体$\stackrel{⑤}{→}$白色粉末,根据钠及其化合物的性质分析,下列说法正确的是( )
| A. | ①发生了氧化还原反应 | |
| B. | ①变灰暗是因为生成了过氧化钠 | |
| C. | ③是碳酸钠吸收空气中的水蒸气形成了溶液 | |
| D. | ④⑤只发生物理变化 |
8.下列说法正确的是( )
| A. | 淀份与纤维素结构简式相同,互为同分异构体 | |
| B. | 聚乙烯、油脂、铜氨纤维、光导纤维都属于高分子 | |
| C. | 甲烷的二氯代物只有一种可证明甲烷为正四面体结构 | |
| D. | 蔗糖遇浓硫酸生碳化现象,但遇稀硫酸不会发生反应 |
15.下列说法正确的是 ( )
| A. | 强电解质溶液一定比弱电解质溶液的导电性强 | |
| B. | 强电解质的稀溶液中不存在溶质分子 | |
| C. | 弱电解质不一定都是共价化合物 | |
| D. | 不同的弱电解质只要物质的量浓度相同,电离程度就相同 |
12.下列指定试剂能检验对应一组物质的是( )
| 选项 | 试剂(必要时可加热 | 物质 |
| A | 硝酸银溶液 | 氯化钠溶液和碳酸钠溶液 |
| B | 氯气 | 硫酸亚铁溶液和FeCl2溶液 |
| C | MnO2 | 浓盐酸和稀硫酸 |
| D | 紫色石蕊试剂 | 次氯酸钙和次氯酸钠 |
| A. | A | B. | B | C. | C | D. | D |
13. 工业上合成尿素(H2NCONH2)分为两步:
工业上合成尿素(H2NCONH2)分为两步:
第一步,将液态氨气与气态CO2化合得到氨基甲酸铵(H2NCOONH4);
第二步,将氨基甲酸铵分解得到尿素:
H2NCOONH4(l)?H2O(1)+H2NCONH2 (1)△H1═+226.3kJ•mol-1.
(1)已知总反应的热化学方程式为:2NH3(l)+CO2(g)?H2O(1)+H2NCONH2 (1)△H2=-103.7kJ•mol-1.
①下列能提高尿素产率的措施是B.
A.升温 B.加压 C.添加催化剂
②写出第一步反应的热化学方程式2NH3(l)+CO2(g)?H2NCOONH4(l)△H=-330.0kJ•mol-1.
(2)已知:NH2COONH4(s)?2NH3(g)+CO2(g).某实验小组在一固定容积的密闭容器中加入NH2COONH4(s)进行实验,以探究外界因素对化学平衡移动的影响,记录了下列数据.
①下列能判断该反应达到平衡的是C
A.2v正(NH3)═v逆(CO2) B.密闭容器中氨气的体积分数不变
C.密闭容器中气体总浓度不变 D.混合气体的平均相对分子质量不变
②25.0℃与15.0℃时的平衡常数之比是8.
③上表实验的目的是探究温度对化学平衡的影响,通过数据分析得出的结论是升高温度平衡正向进行,正反应为吸热反应.
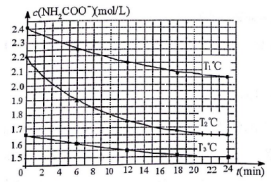
(3)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
①计算T3℃时,0~12min氨基甲酸铵水解反应的平均速率0.0083mol/(L•min) (保留2位有效数字).
②比较图中T1、T2的大小:T1<T2(填“>”、“=”或“<”),判断的理由是T2℃反应物起始浓度比T1°C小,但相同时间内0-6min的平均反应速率仍比T1°C时的大.
 工业上合成尿素(H2NCONH2)分为两步:
工业上合成尿素(H2NCONH2)分为两步:第一步,将液态氨气与气态CO2化合得到氨基甲酸铵(H2NCOONH4);
第二步,将氨基甲酸铵分解得到尿素:
H2NCOONH4(l)?H2O(1)+H2NCONH2 (1)△H1═+226.3kJ•mol-1.
(1)已知总反应的热化学方程式为:2NH3(l)+CO2(g)?H2O(1)+H2NCONH2 (1)△H2=-103.7kJ•mol-1.
①下列能提高尿素产率的措施是B.
A.升温 B.加压 C.添加催化剂
②写出第一步反应的热化学方程式2NH3(l)+CO2(g)?H2NCOONH4(l)△H=-330.0kJ•mol-1.
(2)已知:NH2COONH4(s)?2NH3(g)+CO2(g).某实验小组在一固定容积的密闭容器中加入NH2COONH4(s)进行实验,以探究外界因素对化学平衡移动的影响,记录了下列数据.
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v正(NH3)═v逆(CO2) B.密闭容器中氨气的体积分数不变
C.密闭容器中气体总浓度不变 D.混合气体的平均相对分子质量不变
②25.0℃与15.0℃时的平衡常数之比是8.
③上表实验的目的是探究温度对化学平衡的影响,通过数据分析得出的结论是升高温度平衡正向进行,正反应为吸热反应.
(3)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
①计算T3℃时,0~12min氨基甲酸铵水解反应的平均速率0.0083mol/(L•min) (保留2位有效数字).
②比较图中T1、T2的大小:T1<T2(填“>”、“=”或“<”),判断的理由是T2℃反应物起始浓度比T1°C小,但相同时间内0-6min的平均反应速率仍比T1°C时的大.