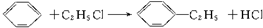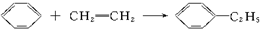题目内容
11.下列说法不正确的是( )| A. | 硅酸盐工业使用的每一种原料中都含有硅元素 | |
| B. | 水泥.普通玻璃都是混合物 | |
| C. | 生产水泥和玻璃都需用石灰石 | |
| D. | 用纯净的石英可制成石英玻璃,它的膨胀系数小,常用来制造耐高温的化学仪器 |
分析 A.硅酸盐工业中,制玻璃的原料中使用了纯碱、碳酸钙,不含有硅元素;
B.混合物是由两种或者两者以上物质组成;
C.生产玻璃的原料是纯碱、石灰石和石英,生产水泥以黏土和石灰石为主要原料;
D.石英玻璃成分为二氧化硅,属于原子晶体,据此分析纯石英的用途.
解答 解:A.硅酸盐工业中,制玻璃的原料中使用了纯碱、碳酸钙,这些原料中不含有硅,故A错误;
B.普通玻璃的组成成分是Na2SiO3、CaSiO3、SiO2,水泥主要成分是硅酸三钙 3CaO•SiO2 硅酸二钙 2CaO•SiO2 和铝酸三钙3CaO•Al2O3等,两者都是混合物,故B正确;
C.生产玻璃的原料是纯碱、石灰石和石英,生产水泥以黏土和石灰石为主要原料,都用到的原料是石灰石,故C正确;
D.纯净的石英可制成石英玻璃,成分为二氧化硅,属于原子晶体,热稳定性高,它的膨胀系数小,常用来制造耐高温的化学仪器,故D正确;
故选A.
点评 本题主要考查了硅酸盐材料的制备及用途,熟悉硅酸盐材料的定义、玻璃、水泥的制备过程是解题关键,题目难度不大.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
1.在合成氨反应中,由a mol N2和b mol H2混合反应达到平衡时,有c mol NH3生成,则NH3在反应混合物中所占的体积分数是( )
| A. | $\frac{100c}{a+b}$% | B. | $\frac{a}{a+b+c}$×100% | C. | $\frac{100c}{a+b-c}$% | D. | $\frac{100c}{a+b-\frac{c}{2}}$% |
2.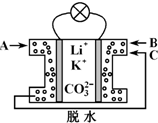 熔融碳酸盐燃料电池是一种高温电池,具有效率高、噪音低、无污染、燃料多样化、余热利用价值高和电池构造材料价廉等诸多优点,是未来的绿色电站.某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图.下列说法正确的是( )
熔融碳酸盐燃料电池是一种高温电池,具有效率高、噪音低、无污染、燃料多样化、余热利用价值高和电池构造材料价廉等诸多优点,是未来的绿色电站.某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图.下列说法正确的是( )
 熔融碳酸盐燃料电池是一种高温电池,具有效率高、噪音低、无污染、燃料多样化、余热利用价值高和电池构造材料价廉等诸多优点,是未来的绿色电站.某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图.下列说法正确的是( )
熔融碳酸盐燃料电池是一种高温电池,具有效率高、噪音低、无污染、燃料多样化、余热利用价值高和电池构造材料价廉等诸多优点,是未来的绿色电站.某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图.下列说法正确的是( )| A. | Li+、K+移向左侧电极 | |
| B. | 外电路中电子由右侧电极移向左侧电极 | |
| C. | 通入1 mol气体A时,左侧电极上生成5 mol CO2 | |
| D. | 相同条件下通入气体B与气体C的体积比为2:1 |
19.下列物质不能与乙醇发生酯化反应的是( )
| A. | CH3COOH | B. | HNO3 | C. | C17H35COOH | D. | CH3OH |
16.下列溶液中的Na+与50mL1mol/LNa3PO4溶液中的Na+的物质的量浓度相等的是( )
| A. | 150mL3mol/LNaCl溶液 | B. | 75mL2mol/LNaNO3溶液 | ||
| C. | 150mL2mol/LNa2SO4溶液 | D. | 75mL1mol/LNa2S |
20.锌-锰碱性电池以KOH溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s).下列说法正确的是( )
| A. | 电池工作时,电子由正极通过外电路流向负极 | |
| B. | 该电池反应中二氧化锰作正极,发生氧化反应 | |
| C. | 该电池工作时,电解液中的K+向锌极定向移动 | |
| D. | 电池负极的反应式为:Zn(s)-2e-+2OH-(aq)=Zn(OH)2(s) |
1.下列说法正确的是( )
| A. | 按系统命名法,有机物 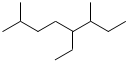 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |||||||||
| B. | 已知Ka是平衡常数,PKa=-lgKa
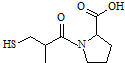 图所示有机物1mol最多能消耗含3molNaOH的溶液 图所示有机物1mol最多能消耗含3molNaOH的溶液 | |||||||||
| C. | 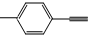 分子中所有原子共平面 分子中所有原子共平面 | |||||||||
| D. | 碳原子数小于或等于4的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有3种 |
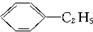 )的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
)的方法中,原子经济性最好的是(反应均在一定条件下进行)( )