题目内容
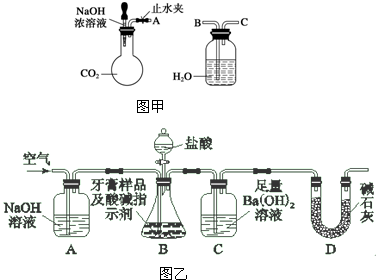
 在MgCl2和AlCl3的混合溶液中,逐滴加入1mol?L-1的NaOH溶液直至过量.经测定,加入的NaOH溶液的体积(L)和所得沉淀的物质的量(mol)的关系如图所示.
在MgCl2和AlCl3的混合溶液中,逐滴加入1mol?L-1的NaOH溶液直至过量.经测定,加入的NaOH溶液的体积(L)和所得沉淀的物质的量(mol)的关系如图所示.(1)写出OA段发生反应的离子方程式:
(2)图中B点表示的溶液中所含的溶质为
(3)原溶液中Mg2+、Al3+物质的量浓度之比为
考点:离子方程式的有关计算
专题:计算题
分析:氯化镁和氯化铝均可以和氢氧化钠发生反应,生成沉淀氢氧化镁和氢氧化铝,氢氧化铝能和氢氧化钠继续反应,直至氢氧化铝全部被消耗,根据n(MgCl2)=n(Mg(OH)2],n(Al3+)=n(NaAlO2)=n(Al(OH)3)结合原子守恒知识来回答判断即可.
解答:
解:(1)氯化镁和氯化铝均可以和氢氧化钠发生反应,生成沉淀氢氧化镁和氢氧化铝,则OA段发生反应的离子方程式Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓;
故答案为:Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓;
(2)氢氧化铝能和氢氧化钠继续反应,直至氢氧化铝全部被消耗,则B点时氢氧化铝全部转化为NaAlO2,则溶液中溶质为NaAlO2、NaCl;
故答案为:NaAlO2、NaCl;
(3)B点沉淀为0.2mol,则氢氧化镁为0.2mol,由方程式Mg2++2OH-=Mg(OH)2↓可知,与镁离子反应消耗的氢氧化钠为0.4mol,则氢氧化钠的体积为
=0.4L,已知共消耗0.8L氢氧化钠,则与铝离子反应生成偏铝酸钠消耗的氢氧化钠为0.4L,即与铝离子反应的氢氧化钠为0.4mol,由Al3++4OH-=AlO2-+2H2O可知,n(Al3+)=0.1mol,则原溶液中Mg2+、Al3+物质的量浓度之比为2:1;
y×1mol/L=0.2mol×2+0.1mol×3,则y=0.5L;
故答案为:2:1;0.5.
故答案为:Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓;
(2)氢氧化铝能和氢氧化钠继续反应,直至氢氧化铝全部被消耗,则B点时氢氧化铝全部转化为NaAlO2,则溶液中溶质为NaAlO2、NaCl;
故答案为:NaAlO2、NaCl;
(3)B点沉淀为0.2mol,则氢氧化镁为0.2mol,由方程式Mg2++2OH-=Mg(OH)2↓可知,与镁离子反应消耗的氢氧化钠为0.4mol,则氢氧化钠的体积为
| 0.4mol |
| 1mol/L |
y×1mol/L=0.2mol×2+0.1mol×3,则y=0.5L;
故答案为:2:1;0.5.
点评:本题考查了混合物和化学方程式的计算,图象分析判断,化学方程式的计算应用,题目难度中等.

练习册系列答案
相关题目
设阿伏加德罗常数为NA,下列说法正确的是( )
| A、在标准状况下,2.24 L H2O中含有0.1 NA个水分子 |
| B、0.1mol/LNaCl溶液中含有Na+数为0.1NA |
| C、1molFe与足量盐酸完全反应,Fe失去的电子数为2NA |
| D、在常温下,1molH2含有的原子数一定不是2NA |
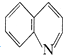 )是一种重要的有机化合物,其合成路线如下:
)是一种重要的有机化合物,其合成路线如下: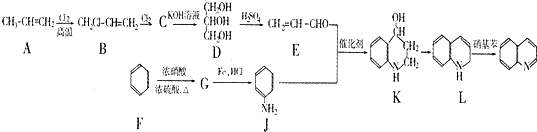
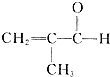 制备物质K的同系物:
制备物质K的同系物: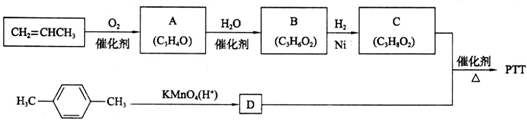
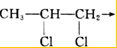




 ,合成路线是
,合成路线是