题目内容
镁燃料电池以镁合金作为电极的一极,另一极充入过氧化氢,电解质是酸化的氯化钠溶液,放电时总反应为:Mg+2H++H2O2=Mg2++2H2O,关于该电池的说法不正确的是( )
| A、镁合金为电源负极,发生氧化反应 |
| B、电解质溶液中的H+向正极移动 |
| C、正极反应为:H2O2+2e-=2OH- |
| D、放电时正极周围溶液的pH升高 |
考点:化学电源新型电池
专题:电化学专题
分析:该原电池中,Mg易失电子作负极,电极反应式为Mg-2e-=Mg2+,正极反应为2H++H2O2+2e-=2H2O,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,据此分析解答.
解答:
解:A.镁合金易失电子作负极,发生氧化反应,故A正确;
B.放电时,电解质溶液在氢离子向正极移动,故B正确;
C.正极反应为2H++H2O2+2e-=2H2O,故C错误;
D.放电时,正极反应为2H++H2O2+2e-=2H2O,氢离子浓度降低导致溶液的pH升高,故D正确;
故选C.
B.放电时,电解质溶液在氢离子向正极移动,故B正确;
C.正极反应为2H++H2O2+2e-=2H2O,故C错误;
D.放电时,正极反应为2H++H2O2+2e-=2H2O,氢离子浓度降低导致溶液的pH升高,故D正确;
故选C.
点评:本题考查了化学电源新型电池,根据电池反应式正确书写电极反应式是解本题关键,再结合离子移动方向、电极反应式分析解答,题目难度不大.

练习册系列答案
相关题目
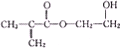 甲基丙烯酸烃乙酯是一种有机合成中重要的原料,其结构简式如图所示,下列有关说法错误的是( )
甲基丙烯酸烃乙酯是一种有机合成中重要的原料,其结构简式如图所示,下列有关说法错误的是( )| A、能发生加成反应 |
| B、能发生取代反应 |
| C、一定条件下,能与乙醇发生酯化反应 |
| D、既能是溴水褪色,又能使酸性高猛酸钾溶液褪色 |
在标准状况下,相同质量的下列气体体积最大的是( )
| A、CH4 |
| B、O2 |
| C、Cl2 |
| D、CO2 |
元素周期律的发现对新元素的发现、化学理论和实验等研究工作起到了指导作用.周期律揭示的规律包括以下内容中的( )
①元素的性质随原子序数的递增呈周期性变化
②元素的性质是元素原子序数的周期性函数
③事物的量变可以引起质变
④元素性质的递变是原子核外电子排布的必然结果.
①元素的性质随原子序数的递增呈周期性变化
②元素的性质是元素原子序数的周期性函数
③事物的量变可以引起质变
④元素性质的递变是原子核外电子排布的必然结果.
| A、①② | B、①③ |
| C、①④ | D、①②③④ |
已知某密闭容器中发生反应:X(g)+2Y(g)?W(g)+Z(g),△H<0(Y物质极易被熔化),下列说法一定正确的是( )
| A、若W为有颜色的物质,达到平衡后,增大压强,体系颜色变浅 |
| B、改变压强但不改变温度,该反应平衡常数不变 |
| C、平衡时,其它条件不变,升高温度,正反应速率增大程度比逆反应率增大程度小 |
| D、平衡时,其它条件不变,分离出Z,正反应速率加快 |
下列化工生产过程所发生的反应不属于氧化还原反应的是( )
| A、用氯气和消石灰制漂白粉 |
| B、用纯碱、石灰石和石英制普通玻璃 |
| C、用石油炼制过程脱硫得到的硫磺制造硫酸 |
| D、用金属钠从四氯化钛(TiCl4)中提炼金属钛 |
将5mol/L的盐酸10mL稀释到100mL,再从中取出5mL,这5mL溶液的物质的量浓度为( )
| A、0.5mol/L |
| B、0.25mol/L |
| C、5mol/L |
| D、1mol/L |
设阿伏加德罗常数的值为NA,下列叙述正确的是( )
A、常温下,1L 0.1mol?L-1的NH4NO3溶液中NH
| ||
| B、常温下,4.4g CO2和N2O混合物中所含有的原子数为0.3NA | ||
| C、标准状况下,2.24L乙烷中含有的非极性键数为0.7NA | ||
| D、1molCl2与足量的氢氧化钠溶液反应转移的电子数为2NA |