题目内容
17.下列物质在水中的电离方程式书写正确的是( )| A. | Al2(SO4)3═2Al3++3SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaHSO4═Na++HSO4- | D. | KClO3═K++Cl-+3O2- |
分析 A.硫酸铝是强电解质,完全电离生成铝离子和硫酸根离子;
B.碳酸氢钠是弱电解质,完全电离生成金属阳离子和酸式酸根离子;
C.硫酸氢钠是强酸强碱盐,在水溶液中完全电离生成钠离子、氢离子和硫酸根离子;
D.氯酸钾是强电解质,在水溶液中完全电离生成钾离子和酸根离子.
解答 解:A.硫酸铝是强电解质,完全电离生成铝离子和硫酸根离子,电离方程式为Al2(SO4)3═2Al3++3SO42-,故A正确;
B.碳酸氢钠是弱电解质,完全电离生成金属阳离子和酸式酸根离子,电离方程式为NaHCO3═Na++HCO3-,故B错误;
C.硫酸氢钠是强酸强碱盐,在水溶液中完全电离生成钠离子、氢离子和硫酸根离子,电离方程式为NaHSO4═Na++H++SO42-,故C错误;
D.氯酸钾是强电解质,在水溶液中完全电离生成钾离子和酸根离子,电离方程式为KClO3═K++ClO3-,故D错误;
故选A.
点评 本题考查电离方程式的书写,为高频考点,明确电解质强弱及电解质电离方式是解本题关键,注意:多个原子的酸根离子是原子团,不能拆开,弱酸酸式盐电离时要写弱酸酸式酸根离子,强酸酸式盐不能写酸式酸根离子,注意比较BC电离方式区别,题目难度不大.

练习册系列答案
相关题目
7.从碘水中萃取碘,能够选用的试剂是( )
| A. | 乙醇 | B. | 盐酸 | C. | 醋酸 | D. | 四氯化碳 |
5.若溶液中由水电离产生的C(OH-)=1.0×1013mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
| A. | Na+、Fe2+、NO3-、Cl- | B. | Na+、K+、NO3-、Cl- | ||
| C. | Na+、K+、AlO2-、Cl- | D. | NH4+、K+、SO42-、HCO3- |
12.反应4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O是工业制硝酸的重要一步,有关该反应的说法正确的是( )
| A. | NH3被氧化 | B. | NH3是氧化剂 | C. | NO是还原产物 | D. | H2O是氧化产物 |
2.2SO2(g)+O2(g)$?_{△}^{V_{2}O_{5}}$2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
| A. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| B. | 增大反应体系的压强,反应速率一定增大 | |
| C. | 进入接触室的SO2和空气必须进行净化,且该反应不需要在高压下进行 | |
| D. | 催化剂V2O5能增大该反应的正反应速率而不改变逆反应速率 |
9.同温同压下,2体积某气体分解成1体积X2气体与3体积Y2气体,则该化合物的化学式为( )
| A. | XY | B. | X3Y | C. | XY3 | D. | X2Y3 |
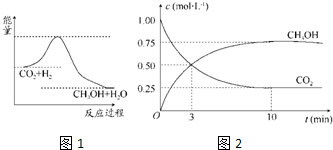
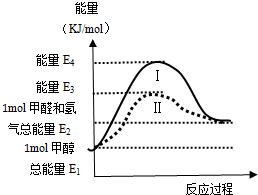 甲醇是重要的化工原料,气态甲醇催化脱氢制备甲醛转化的能量关系如图所示.
甲醇是重要的化工原料,气态甲醇催化脱氢制备甲醛转化的能量关系如图所示.