题目内容
16.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(H+) | |
| B. | 0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
分析 A.两溶液恰好反应生成醋酸和氯化钠,醋酸部分电离,溶液呈酸性,由于氢离子来自水的电离和醋酸的电离,则c(H+)>c(CH3COO-);
B.溶液的pH大于7,则一水合氨的电离程度大于铵根离子的水解程度,c(NH3•H2O)<c(NH4+);
C.根据混合液中的物料守恒分析;
D.根据混合液中的电荷守恒判断.
解答 解:A.溶液为氯化钠和醋酸混合溶液,且二者的物质的量浓度相等,混合溶液呈酸性,溶液中c(OH-)很小,且混合溶液中存在物料守恒,根据物料守恒得c(Na+)=c(Cl-),醋酸部分电离,由于氢离子来自水的电离和醋酸的电离,则c(H+)>c(CH3COO-),溶液中正确的离子浓度大小为:c(Na+)=c(Cl-)>c(H+)>c(CH3COO-),故A错误;
B.混合溶液呈碱性,说明NH3•H2O的电离程度大于NH4+的水解程度,则溶液中c(NH3•H2O)<c(NH4+),故B错误;
C.混合溶液存在物料守恒,根据物料守恒得:0.1mol•L-1Na2CO3溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),0.1mol•L-1NaHCO3溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),两式相加得:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),即 $\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故C正确;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、电荷守恒、物料守恒的含义为解答关键,A为易错点,注意醋酸溶液中c(H+)>c(CH3COO-).

 教学练新同步练习系列答案
教学练新同步练习系列答案| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | 将a mol•L-1 HCN溶液与a mol•L-1 NaOH溶液等体积混合,混合液中:c(OH-)>c(H+),c(Na+)>c(CN-) | |
| C. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 | |
| D. | NaHCO3和Na2CO3混合液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| A. | 80g硝铵含有氮原子数为2NA | |
| B. | 1L1mol•L-1的盐酸溶液中,所含氯化氢分子数为NA | |
| C. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA | |
| D. | 在铁与盐酸的反应中,铁的化合价显+3 |
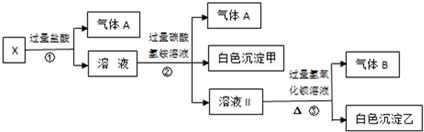
| A. | 气体A是CO2,白色沉淀甲是氢氧化铝 | |
| B. | 溶液中一定不含Ag+、Fe3+、SO42- | |
| C. | 溶液Ⅱ是硫酸钠、碳酸氢铵、氯化钠的混合物 | |
| D. | 溶液中一定存在的离子有Na+、CO32-、AlO2-和SO42- |
| A. | Al | B. | Al(OH)3 | C. | AlCl3 | D. | Al2O3 |
| A. | 滴加酚酞显无色溶液 | B. | c(OH-)<c(H+)的溶液 | ||
| C. | pH<7的溶液 | D. | 滴加甲基橙显黄色溶液 |
| 化学事实 | 主要影响因素 | |
| (1) | 集气瓶中有H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸 | |
| (2) | 黄铁矿煅烧前,要先粉碎成细小的矿粒 | |
| (3) | 实验室用浓盐酸而不用稀盐酸与MnO2反应制备氯气 |
| A. | 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl->c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol/L NH4Cl溶液与5mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
