题目内容
实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,装置D中硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物.
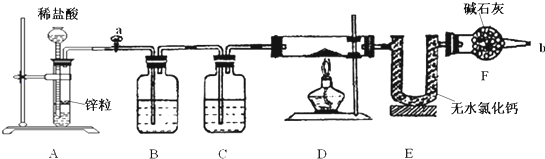
(1)为了安全,在点燃D处的酒精灯之前,在b出口处必须 .
(2)装置B的作用是 .
装置C中装的液体是 ,所起的作用是 .
(3)硬质双通玻璃管中发生的化学反应方程式是: , .
(4)若FeO和Fe2O3固体混合物的质量为23.2g,反应完全后U型管的质量增加7.2g,则混合物中Fe2O3的质量为 g.
(5)若装置中无干燥管F,则测得的Fe2O3质量将 (填“偏大”、“偏小”或“无影响”).
(6)若反应后得到的残留固体中还有少量FeO,则测得的Fe2O3质量将 填“偏大”、“偏小”或“无影响”).

(1)为了安全,在点燃D处的酒精灯之前,在b出口处必须
(2)装置B的作用是
装置C中装的液体是
(3)硬质双通玻璃管中发生的化学反应方程式是:
(4)若FeO和Fe2O3固体混合物的质量为23.2g,反应完全后U型管的质量增加7.2g,则混合物中Fe2O3的质量为
(5)若装置中无干燥管F,则测得的Fe2O3质量将
(6)若反应后得到的残留固体中还有少量FeO,则测得的Fe2O3质量将
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)氢气是可燃性气体加热或点燃前需要进行验纯;
(2)A中产生的H2中混有HCl和水蒸气,必须通过洗气逐一除去,防止干扰后续实验;
(3)D装置发生的反应是氢气还原氧化亚铁、氧化铁的反应,生成了铁和水;
(4)根据氧化铁、氧化亚铁的总质量及U型管的质量增加7.2g为水的质量列式计算;
(5)若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,氧元素物质的量偏大,Fe2O3的质量也将偏大;
(6)根据(6)的计算结果来分析判断即可.
(2)A中产生的H2中混有HCl和水蒸气,必须通过洗气逐一除去,防止干扰后续实验;
(3)D装置发生的反应是氢气还原氧化亚铁、氧化铁的反应,生成了铁和水;
(4)根据氧化铁、氧化亚铁的总质量及U型管的质量增加7.2g为水的质量列式计算;
(5)若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,氧元素物质的量偏大,Fe2O3的质量也将偏大;
(6)根据(6)的计算结果来分析判断即可.
解答:
解:(1)氢气是可燃性气体,装置中需要充满氢气后方可进行加热反应,所以需要对氢气进行验纯,避免混有空气加热发生爆炸,在F处b口收集氢气验纯;
故答案为:收集氢气验纯;
(2)由于A中产生的H2中混有HCl和水蒸气,必须通过洗气逐一除去,防止干扰后续实验,所以B的作用是除去氢气中的氯化氢,C的浓硫酸,用于干燥氢气,
故答案为:除去氢气中的氯化氢;浓硫酸;除水蒸气或干燥氢气;
(3)装置D中发生的是氧化亚铁、氧化铁与氢气的反应,反应方程式为:3H2+Fe2O3
2Fe+3H2O,H2+FeO
Fe+H2O,
故答案为:3H2+Fe2O3
2Fe+3H2O,H2+FeO
Fe+H2O;
(4)U型管的质量增加的7.2g是水,物质的量是
=0.4mol,
设FeO、Fe2O3物质的量分别为X、Y,则:X+3Y=0.4
根据质量可列式:72X+160Y=23.2
解得Y=0.1,X=0.1,
所以氧化铁的质量为:160g/mol×0.1mol=16g,
故答案为:16g;
(5)干燥管F的作用防空气中水蒸气对实验干扰,若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,导致氧的含量增大,Fe2O3的质量将偏大,
故答案为:偏大;
(6)若反应后得到的残留固体中还有少量FeO,即上式中X偏小,则Y偏大,测得的Fe2O3质量将偏大,
故答案为:偏大.
故答案为:收集氢气验纯;
(2)由于A中产生的H2中混有HCl和水蒸气,必须通过洗气逐一除去,防止干扰后续实验,所以B的作用是除去氢气中的氯化氢,C的浓硫酸,用于干燥氢气,
故答案为:除去氢气中的氯化氢;浓硫酸;除水蒸气或干燥氢气;
(3)装置D中发生的是氧化亚铁、氧化铁与氢气的反应,反应方程式为:3H2+Fe2O3
| ||
| ||
故答案为:3H2+Fe2O3
| ||
| ||
(4)U型管的质量增加的7.2g是水,物质的量是
| 7.2g |
| 18g/mol |
设FeO、Fe2O3物质的量分别为X、Y,则:X+3Y=0.4
根据质量可列式:72X+160Y=23.2
解得Y=0.1,X=0.1,
所以氧化铁的质量为:160g/mol×0.1mol=16g,
故答案为:16g;
(5)干燥管F的作用防空气中水蒸气对实验干扰,若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,导致氧的含量增大,Fe2O3的质量将偏大,
故答案为:偏大;
(6)若反应后得到的残留固体中还有少量FeO,即上式中X偏小,则Y偏大,测得的Fe2O3质量将偏大,
故答案为:偏大.
点评:本题考查了测定FeO和Fe2O3固体混合物中Fe2O3的质量,是一道综合实验题,解题的关键是掌握各种装置的作用,并能根据相关的数据进行计算,此题对训练学生思维能力有一定帮助,本题难度中等.

练习册系列答案
相关题目
下列各组混合物中,能用分液漏斗进行分离的是( )
| A、酒精与水 | B、碘与四氯化碳 |
| C、水与苯 | D、汽油和植物油 |
化学是一门以实验为基础的科学,掌握好化学实验基本操作是做好化学实验的前提.下列操作正确的是( )
| A、给试管内的液体加热,可使试管口对准自己,不能对准别人 |
| B、用规格为50 mL的量筒量取2.5 mL的液体 |
| C、称量NaOH固体的质量时,把NaOH固体直接放到天平左边的托盘上 |
| D、实验室制取氧气时,先检查装置的气密性,然后再加药品 |
下列各组溶液,不加任何试剂(可加热)就可以区别的是( )
| A、Na2S、Na2SO3、AgNO3、NaCl、NaOH |
| B、HCHO、CuSO4、NaOH、FeCl2、FeSO4 |
| C、Br2、CH3CHO、CH3COOH、Ag(NH3)2Cl、NaHCO3 |
| D、KAl(SO4)2、NaHSO4、Al2(SO4)3、KCl、MgCl2 |

