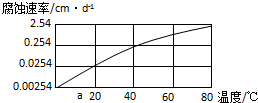
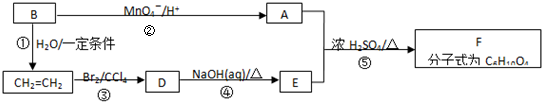
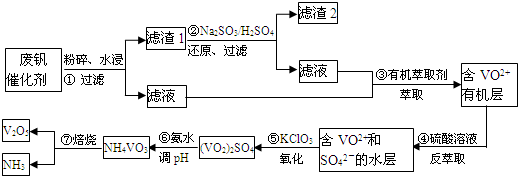
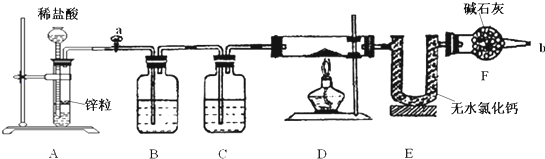
题目内容
A、B、C、D、E、F是原子序数依次增大的同周期元素,已知A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的次外层电子数比最外层电子数多4个,E元素原子最外层与最内层电子数的差是3,试回答:
(1)写出下列元素的元素符号:A ,C ,D ,E .
(2)写出A、C、F三种元素最高价氧化物的水化物相互反应的化学方程式 , , .
(1)写出下列元素的元素符号:A
(2)写出A、C、F三种元素最高价氧化物的水化物相互反应的化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:D的次外层电子数比最外层电子数多4个,说明其次外层电子数为8,则D为Si元素;
E元素原子最外层与最内层电子数的差是3,E的最内层电子数为2,最外层电子数为5,故E为P元素;
A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,则C为Al,A为金属,只能为Na元素,则F的最外层电子数为:11-1-3=7,则F为Cl元素;
A、B、C的原子序数依次增大,则B为Mg元素.
E元素原子最外层与最内层电子数的差是3,E的最内层电子数为2,最外层电子数为5,故E为P元素;
A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,则C为Al,A为金属,只能为Na元素,则F的最外层电子数为:11-1-3=7,则F为Cl元素;
A、B、C的原子序数依次增大,则B为Mg元素.
解答:
解:(1)D的次外层电子数比最外层电子数多4个,说明其次外层电子数为8,则D为Si元素;E元素原子最外层与最内层电子数的差是3,E的最内层电子数为2,最外层电子数为5,故E为P元素;A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,则C为Al,A为金属,只能为Na元素,则F的最外层电子数为:11-1-3=7,则F为Cl元素;A、B、C的原子序数依次增大,则B为Mg元素,
根据分析可知:A为Na、B为Mg、C为Al、D为Si、E为P、F为Cl元素,
故答案为:Na;Al;Si;P;
(2)A为Na、C为Al、F为Cl元素,A、C、F三种元素最高价氧化物的水化物分别为:NaOH、Al(OH)3、HClO4,NaOH、Al(OH)3、HClO4相互反应的化学方程式:NaOH+Al(OH)3═NaAlO2+2H2O、NaOH+HClO4═NaClO4+H2O、Al(OH)3+3HClO4═Al(ClO4)3+3H2O,
故答案为:NaOH+Al(OH)3═NaAlO2+2H2O;NaOH+HClO4═NaClO4+H2O;Al(OH)3+3HClO4═Al(ClO4)3+3H2O.
根据分析可知:A为Na、B为Mg、C为Al、D为Si、E为P、F为Cl元素,
故答案为:Na;Al;Si;P;
(2)A为Na、C为Al、F为Cl元素,A、C、F三种元素最高价氧化物的水化物分别为:NaOH、Al(OH)3、HClO4,NaOH、Al(OH)3、HClO4相互反应的化学方程式:NaOH+Al(OH)3═NaAlO2+2H2O、NaOH+HClO4═NaClO4+H2O、Al(OH)3+3HClO4═Al(ClO4)3+3H2O,
故答案为:NaOH+Al(OH)3═NaAlO2+2H2O;NaOH+HClO4═NaClO4+H2O;Al(OH)3+3HClO4═Al(ClO4)3+3H2O.
点评:本题考查了位置结构与性质关系的综合应用,题目难度中等,试题侧重基础知识的考查,明确各元素名称为解答关键,注意掌握常见元素的原子结构、元素周期表结构及元素周期律的内容.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法不正确的是( )
A、按系统命名法,化合物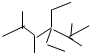 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 |
| B、等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等 |
| C、苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 |
D、结构片段为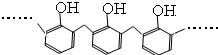 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
燃烧2mol某有机物,可以收集到标准状况下89.6L的CO2和6mol的H2O,试推断该有机物的分子式是( )
| A、C2H4 |
| B、C2H4O |
| C、C2H6 |
| D、C3H6O |
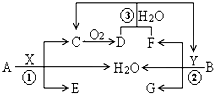 已知两种常见金属A、B分别与两种酸X、Y发生反应各生成三种产物,其转化关系如图所示,其中D为红棕色气体,G溶液呈蓝色.
已知两种常见金属A、B分别与两种酸X、Y发生反应各生成三种产物,其转化关系如图所示,其中D为红棕色气体,G溶液呈蓝色.