题目内容
化学反应原理在科研和生产中有广泛应用.
(1)高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g )═Fe(s)+CO2(g)△H>0,其平衡常数的表达式为K= .已知1100℃时K=0.263,若要提高转化率,可以 (填“升温”、“降温”、“加压”或“减压”).
(2)判断过程的自发性有焓判据和熵判据,涂有防锈漆的钢制器件与没有涂防锈漆的同一刚制器件发生腐蚀过程的自发性是 (填“相同的”,“不同的”,“无法判断”).已知反应2A(g)+B(g)=2C(g),在一定条件下是一个自发的反应,则该反应的△H 0(填“>”、“<”或“=”)
(3)25℃时,H2C2O4═HC2O
+H+的电离平衡常数为Ka=5×10-2,则该温度下NaHC2O4的水解平衡常数Kh= ,若向NaHC2O4溶液中加入少量的水,则溶液中
将 (填“增大”“减小”或“不变”).
(4)利用I2的氧化性可测定钢铁中硫的含量.做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式为 .
(1)高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g )═Fe(s)+CO2(g)△H>0,其平衡常数的表达式为K=
(2)判断过程的自发性有焓判据和熵判据,涂有防锈漆的钢制器件与没有涂防锈漆的同一刚制器件发生腐蚀过程的自发性是
(3)25℃时,H2C2O4═HC2O
- 4 |
| c(H2C2O4) | ||
c(HC2
|
(4)利用I2的氧化性可测定钢铁中硫的含量.做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为
考点:化学平衡常数的含义,焓变和熵变,弱电解质在水溶液中的电离平衡
专题:
分析:(1)依据化学平衡常数概念和化学方程式书写平衡常数表达式;正反应是吸热反应,升温,平衡向吸热反应分析进行,升高温度平衡正向进行,转化率升高;
(2)根据焓判据和熵判据,反应相同,所以焓变和熵变相同,所以反应过程中自发性相同;反应2A(g)+B(g)=2C(g)中,△S<0,要想反应自发△H<0;
(3)根据水解平衡的表达式结合水的离子积综合分析;
(4)因为I2遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂;根据氧化还原反应书写化学方程式.
(2)根据焓判据和熵判据,反应相同,所以焓变和熵变相同,所以反应过程中自发性相同;反应2A(g)+B(g)=2C(g)中,△S<0,要想反应自发△H<0;
(3)根据水解平衡的表达式结合水的离子积综合分析;
(4)因为I2遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂;根据氧化还原反应书写化学方程式.
解答:
解:FeO(s)+CO(g)?Fe(s)+CO2(g)△H>0,其平衡常数表达式为K=
;正反应是吸热反应,升温,平衡向吸热反应分析进行,升高温度平衡正向进行,转化率升高,
故答案为:
;升温;
(2)根据焓判据和熵判据,反应相同,所以焓变和熵变相同,所以反应过程中自发性相同,反应2A(g)+B(g)=2C(g)中,△S<0,要想反应自发△H<0,故答案为:相同的;<;
(3)H2C2O4═)
+H+的电离平衡常数为Ka=
,而Kh=
=
=
=2.0×10-13,向NaHC2O4溶液呈酸性,加入少量的水,促进电离,则溶液中
将变小,故答案为:2.0×10-13;变大;
(4)因为I2遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂,滴定终点时溶液的颜色变化为无色变为蓝色,反应的离子方程式为H2SO3+I2+H2O=4H++SO42-+2I-;
故答案为:淀粉溶液;H2SO3+I2+H2O=4H++SO42-+2I-.
| c(CO2) |
| c(CO) |
故答案为:
| c(CO2) |
| c(CO) |
(2)根据焓判据和熵判据,反应相同,所以焓变和熵变相同,所以反应过程中自发性相同,反应2A(g)+B(g)=2C(g)中,△S<0,要想反应自发△H<0,故答案为:相同的;<;
(3)H2C2O4═)
- 4 |
| c(H+)?c(HC2O4-) |
| c(H2C2O4) |
| c(H2C2O4)?c(OH-) | ||
c(HC2
|
| Kw |
| Ka |
| 1×10-14 |
| 5×10-2 |
| c(H2C2O4) | ||
c(HC2
|
(4)因为I2遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂,滴定终点时溶液的颜色变化为无色变为蓝色,反应的离子方程式为H2SO3+I2+H2O=4H++SO42-+2I-;
故答案为:淀粉溶液;H2SO3+I2+H2O=4H++SO42-+2I-.
点评:本题考查了化学平衡影响因素分析,平衡常数概念计算应用,注意分析判断平衡移动的方法,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
第一位人工合成有机物的化学家是( )
| A、门捷列夫 | B、维勒 |
| C、范特霍夫 | D、勒.贝尔 |
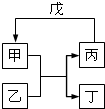 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图5所示转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图5所示转化关系的是( )| 甲 | 乙 | 丙 | 戊 | |
| ① | NH3 | O2 | NO2 | H2 |
| ② | Fe | H2O | Fe3O4 | Al |
| ③ | Al2O3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
| A、①③ | B、②③ | C、②④ | D、①④ |
已知25℃时三种金属硫化物的溶度积常数分别是:KSP(FeS)=6.3×10-18 mol2?L-2、KSP(CuS)=1.3×10-36 mol2?L-2、KSP(MnS)=2.5×10-13mol2?L-2,下列说法中正确的是( )
| A、25℃时,FeS的溶解度大于MnS的溶解度 |
| B、25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol?L-1 |
| C、除去某溶液中的Cu2+,可以选用FeS或MnS作沉淀剂 |
| D、因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生 |
现有Na2CO3、H2SO4、BaCl2三种物质的量浓度与体积都相等的溶液,若将它们都混合起来,并充分反应后过滤,则最后所得滤液中含有的离子有( )
| A、Na+和Cl- |
| B、H+和CO32- |
| C、H+和Cl- |
| D、Na+和SO42- |
下列实验操作与安全事故处理正确的是( )
| A、实验剩余的钠可放入废液缸中 |
| B、用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 |
| C、大量氯气泄漏时,迅速离开现场,并逆风前往安全区域疏散 |
| D、不慎洒出的酒精在桌上着火时,立即用大量水扑灭 |
化学与人类生产、生活、社会可持续发展密切相关,下列说法不正确的是( )
| A、“天宫一号”中使用的碳纤维,是一种新型无机非金属材料 |
| B、为防止富脂食品氧化变质,常在包装袋中放入生石灰 |
| C、开发新能源,减少对化石燃料的依赖,可以促进低碳经济 |
| D、“静电除尘”、“燃烧固硫”、“汽车尾气催化净化”都能提高空气质量 |
短周期元素X、Y、Z、W、U原子序数依次递增.X与W位于同一主族,Z元素的单质既能与盐酸反应也能与NaOH溶液反应,W原子的最外层电子数是次外层电子数的一半,Z、W、U原子的最外层电子数之和为13.Y元素的单质在X的某种氧化物中可燃.下列说法正确的是( )
| A、X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X |
| B、Y、Z元素的单质作电极,在NaOH溶液中构成原电池,Z电极上产生大量气泡 |
| C、室温下,0.05 mol/L U的气态氢化物的水溶液的pH>1 |
| D、Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
