题目内容
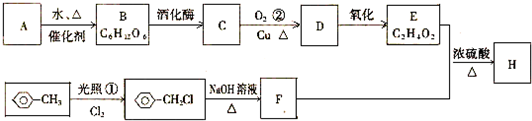
16.一种功能性紫外光固化涂层胶JEA单体N的合成路线如图所示:
已知:环氧烷可以发生加成反应:

(1)A是一种烃,其蒸气密度为同温同压下H2密度的21倍.A的分子式为C3H6.
(2)写出A→B的化学方程式CH2=CHCH3+Cl2$\stackrel{500℃}{→}$CH2=CHCH2Cl+HCl.
(3)已知D分子中含有三元环结构,则D的结构简式为
 .
.②、③两种途径均可得到D,你认为符合“原子经济”要求的合成的途径是②(填序号).
(4)已知F不能发生银镜反应,则E→F的化学方程式为
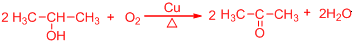 .
.(5)BPA又名双酚A其结构简式如图
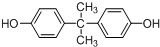 所示,下列说法正确的是ab.
所示,下列说法正确的是ab.a.1mol双酚A与浓溴水发生反应最多消耗4molBr2
b.核磁共振氢谱有4组峰,峰面积之比为3:2:2:1
c.可发生加成、取代、消去等反应
(6)G能使溴的四氯化碳溶液褪色,且可以与新制的Cu(OH)2悬浊液发生反应生成红色沉淀,写出该反应的方程式
 .
.(7)已知N的结构简式如下:

由D、BPA、H合成N的反应类型有取代反应和加成反应.
(8)请任意写出符合下列条件的两种有机物的结构简式(含顺反异构)CH2=CHCH2COOH、CH2=C(CH3)COOH、
 (其中两种)
(其中两种)①与H互为同系物 ②其相对分子质量为86.
分析 A是一种烃,其蒸气密度为同温同压下H2密度的21倍,则A的相对分子质量为42,所以A的分子式为C3H6,A能氧化得G,G能使溴的四氯化碳溶液褪色,说明含有碳碳不饱和键,且A可以与新制的Cu(OH)2悬浊液发生反应生成红色沉淀,说明含有醛基,则G为CH2=CHCHO,所以A为CH2=CHCH3,G发生氧化反应,推断得H为CH2=CHCOOH,根据BPA的结构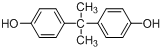 ,F不能发生银镜反应,可知F为CH3COCH3,则E为CH3CHOHCH3,根据N的结构
,F不能发生银镜反应,可知F为CH3COCH3,则E为CH3CHOHCH3,根据N的结构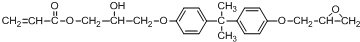 和D分子中含有三元环结构,结合题中信息可知,D为
和D分子中含有三元环结构,结合题中信息可知,D为 ,根据C的分子式可知C为CH2OHCHClCH2Cl或CH2ClCHOHCH2Cl,则B为CH2=CHCH2Cl,据此分析解答.
,根据C的分子式可知C为CH2OHCHClCH2Cl或CH2ClCHOHCH2Cl,则B为CH2=CHCH2Cl,据此分析解答.
解答 解:A是一种烃,其蒸气密度为同温同压下H2密度的21倍,则A的相对分子质量为42,所以A的分子式为C3H6,A能氧化得G,G能使溴的四氯化碳溶液褪色,说明含有碳碳不饱和键,且A可以与新制的Cu(OH)2悬浊液发生反应生成红色沉淀,说明含有醛基,则G为CH2=CHCHO,所以A为CH2=CHCH3,G发生氧化反应,推断得H为CH2=CHCOOH,根据BPA的结构 ,F不能发生银镜反应,可知F为CH3COCH3,则E为CH3CHOHCH3,根据N的结构
,F不能发生银镜反应,可知F为CH3COCH3,则E为CH3CHOHCH3,根据N的结构 和D分子中含有三元环结构,结合题中信息可知,D为
和D分子中含有三元环结构,结合题中信息可知,D为 ,根据C的分子式可知C为CH2OHCHClCH2Cl或CH2ClCHOHCH2Cl,则B为CH2=CHCH2Cl,
,根据C的分子式可知C为CH2OHCHClCH2Cl或CH2ClCHOHCH2Cl,则B为CH2=CHCH2Cl,
(1)根据上面的分析可知,A的分子式为C3H6,
故答案为:C3H6;
(2)A→B的化学方程式为CH2=CHCH3+Cl2$\stackrel{500℃}{→}$CH2=CHCH2Cl+HCl,
故答案为:CH2=CHCH3+Cl2$\stackrel{500℃}{→}$CH2=CHCH2Cl+HCl;
(3)根据上面的分析可知,D的结构简式为 ,②、③两种途径均可得到D,但途径②中原子利用率为100%,所以②符合“原子经济”要求,
,②、③两种途径均可得到D,但途径②中原子利用率为100%,所以②符合“原子经济”要求,
故答案为: ;②;
;②;
(4)已知F不能发生银镜反应,则E→F的化学方程式为  ,
,
故答案为: ;
;
(5)根据 的结构可知,下列说法中
的结构可知,下列说法中
a.1mol双酚A与浓溴水发生取代反应,最多消耗4molBr2,故a正确;
b. 中核磁共振氢谱有4组峰,峰面积之比为3:2:2:1,故b正确;
中核磁共振氢谱有4组峰,峰面积之比为3:2:2:1,故b正确;
c. 中有苯环,可发生加成、取代但不能发生消去反应,故c错误;
中有苯环,可发生加成、取代但不能发生消去反应,故c错误;
故答案为:ab;
(6)G为CH2=CHCHO,可以与新制的Cu(OH)2悬浊液发生反应生成红色沉淀,该反应的方程式为 ,
,
故答案为: ;
;
(7)根据N的结构可知,由D、BPA、H合成N可以由D和H发生加成后与BPA发生取代以及由D与BPA发生取代得到,所以涉及的反应类型有加成反应和取代反应,
故答案为:加成反应和取代反应;
(8)H为CH2=CHCOOH,符合下列条件①与H互为同系物,即含有碳碳双键和羧基;②其相对分子质量为86的有机物的结构简式(含顺反异构)为 CH2=CHCH2COOH、CH2=C(CH3)COOH、 ,
,
故答案为:CH2=CHCH2COOH、CH2=C(CH3)COOH、 (其中两种).
(其中两种).
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,结合习题信息进行推断是解本题关键,知道常见有机物官能团及其性质关系、物质之间的转化、反应条件、反应类型等知识点,难点是同分异构体结构简式确定,题目难度中等.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案| 反应物 | 化学方程式 | 反应类型 |
| ②和④ | ||
| 苯和③ | ||
| ⑥和① |
| A. | 甲烷的燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2则△H1<△H2 | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 已知中和热为△H=-57.3kJ•mol-1,则稀醋酸和稀NaOH溶液反应的热化学方程式为:CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3 kJ•mol-1 |
某同学按表进行实验,请你判断哪一组先出现浑浊.
| 编号 | 1 | 2 | 3 |
| 加3%Na2S2O3溶液 | 5mL | 5mL | 5mL |
| 1:5的硫酸 | 25滴 | 15滴 | 25滴 |
| 温度/℃ | 室温 | 室温+10 | 室温+20 |
| 出现浑浊的快慢 |
 ,
,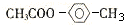 .
.