题目内容
6.己知硫代硫酸钠溶液和稀硫酸反应可析出单质硫沉淀:Na2S2O3+H2S04═Na2SO4+S+SO2+H2O某同学按表进行实验,请你判断哪一组先出现浑浊.
| 编号 | 1 | 2 | 3 |
| 加3%Na2S2O3溶液 | 5mL | 5mL | 5mL |
| 1:5的硫酸 | 25滴 | 15滴 | 25滴 |
| 温度/℃ | 室温 | 室温+10 | 室温+20 |
| 出现浑浊的快慢 |
分析 化学反应速率的影响因素是反应物浓度、反应温度,相同条件下浓度越大、温度越高反应速率越大,温度影响比浓度改变对反应速率影响大,结合图表数据和影响反应速率的因素分析.
解答 解:第3组与1、2两组数据相比,温度最高,反应物硫酸的浓度和第1组相同,但比第2组大,所以第3组先出现浑浊,因为反应温度越高,浓度越大,速率越快,
故答案为:第3组(反应温度越高,浓度越大,速率越快).
点评 本题考查化学反应速率,为高考高频考点,侧重于反应速率的影响因素的考查以及数据处理能力,能较好的培养学生良好的科学素养,难度不大,学习中注意掌握影响化学反应速率的因素.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
17.用NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 11.2LCO和N2混合气体中含有的分子数是0.5NA | |
| B. | 在氯气参与的反应中,22.4L(标况)氯气完全反应得到的电子数一定为0.2NA | |
| C. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 | |
| D. | l L l mol•L-1的NaClO溶液中含有ClO-的数目小于NA |
14.甲、乙两种固体的溶解度曲线如图所示.下列说法中,不正确的是( )


| A. | 20℃时,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数 | |
| B. | 40℃时,分别在100 g水中加入40 g甲、乙,所得溶液溶质的质量分数相等 | |
| C. | 40℃时,分别在100 g水中加入30 g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液 | |
| D. | 20℃时,分别在100 g水中加入40 g甲、乙,加热到40℃时,乙溶液为饱和溶液 |
1.根据热化学方程式(在101kPa下):S(s)+O2(g)═SO2(g)△H=-297.3kJ•mol-1分析下列说法,其中不正确的是( )
| A. | 该条件下32g S(s)完全燃烧放出的热量为297.23kJ | |
| B. | 反应S(g)+O2(g)═SO2(g)的△H大于-297.3kJ•mol-1 | |
| C. | 反应S(g)+O2(g)═SO2(g)的△H小于-297.3kJ•mol-1 | |
| D. | 形成1 mol SO2(g)中的化学键所释放的总能量大于断裂1 mol S(s)和1mol O2(g)中的化学键所吸收 |
18.2015年巴黎气候变化大会规定:本世纪实现温室气体净零排放.下列物质燃烧时能实现二氧化碳零排放的是( )
| A. | 天然气 | B. | 氢气 | C. | 水煤气 | D. | 煤炭 |
5. 某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
部分阳离子以氢氧化物形式沉淀时的pH如表:
(1)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O
操作a中需要的玻璃仪器烧杯、漏斗、玻璃棒
(2)“酸浸”时所加入的酸是H2SO4 (填化学式).
(3)加入H2O2时发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2≤PH<7.1.
 某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式沉淀时的pH如表:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
操作a中需要的玻璃仪器烧杯、漏斗、玻璃棒
(2)“酸浸”时所加入的酸是H2SO4 (填化学式).
(3)加入H2O2时发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2≤PH<7.1.


 .
.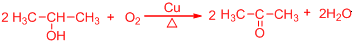 .
.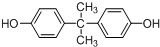 所示,下列说法正确的是ab.
所示,下列说法正确的是ab. .
.
 (其中两种)
(其中两种)