题目内容
6.某元素原子的价电子构型为3s23p3,它属于第三周期,是ⅤA族,最高正化合价为+5,元素名称是磷.分析 电子最后填入的能级是p能级的元素属于P区元素,P区元素的外围电子排布为ns2npx,包含第ⅢA~ⅦA族及零族元素,外围电子排布为3S23p3,属于主族元素,周期数=电子层数、主族族序数=最外层电子数确定其在周期表中的位置,对主族元素最高正化合价=最外层电子数=族序数.
解答 解:外围电子排布为3s23p3,属于主族元素,周期数=3、主族族序数=5,故处于周期表第三周期第ⅤA族,元素名称是磷,最高正化合价=最外层电子数=族序数,故最高正化合价为+5,
故答案为:三;ⅤA;+5;磷.
点评 本题考查元素周期表的结构、原子结构与位置关系、原子核外电子的排布等,题目难度中等,注意整体把握元素周期表,注意掌握原子核外电子的排布规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列叙述中,正确的是( )
| A. | 某物质只含一种元素,则该物质一定是纯净物 | |
| B. | 具有相同质子数的粒子一定属于同一种元素 | |
| C. | 任何原子都是由质子、中子和电子构成 | |
| D. | 溶液、胶体都是混合物 |
6.某温度下,反应I2+I-=I3-的化学平衡常数为800.在该温度下,向甲、乙、丙三个容积相同的容器中分别加入I2和I-,这两种物质的起始浓度如下.
反应速率最快的是丙(填″甲″、″乙″或″丙″,下同),平衡时I2的转化率最大的是甲.
| 起始浓度(mol•L-1) | 甲 | 乙 | 丙 |
| C(I2) | 0.1 | 0.2 | 0.2 |
| C(I-) | 0.2 | 0.1 | 0.2 |
1.现有一根质量为16.8g的表面被氧化的铜丝,将其完全浸没在盛有100g稀硫酸的烧杯中,恰好完全反应后将铜丝取出(不考虑实验中的损失),烧杯内物质的总质量为104g,则原铜丝中表面被氧化的铜占原铜丝的质量分数为( )
| A. | 30% | B. | 20% | C. | 40% | D. | 35% |
11.下列各组物质混合后,再加热蒸干并充分灼烧至质量不变,最终一定能得到纯净物的是( )
| A. | 向带有氧化膜的铝片中加入盐酸 | |
| B. | 向NaHCO3溶液中加入一定质量的Na2O2粉末 | |
| C. | 向漂白粉浊液中通入过量CO2 | |
| D. | 向NaOH溶液中加入过量AlCl3 |
18.下列物质不含有共价键的是( )
| A. | NaCl | B. | CO2 | C. | NaOH | D. | O3 |
15.室温时,下列液体的密度比水密度大的是( )
| A. | 溴苯 | B. | 苯 | C. | 己烷 | D. | 汽油 |


 .
.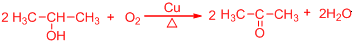 .
.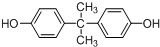 所示,下列说法正确的是ab.
所示,下列说法正确的是ab. .
.
 (其中两种)
(其中两种)