题目内容
3.环戊二烯( )是一种重要的化工原料,下面是以环戊烷为原料制备环戊二烯的合成路线:
)是一种重要的化工原料,下面是以环戊烷为原料制备环戊二烯的合成路线: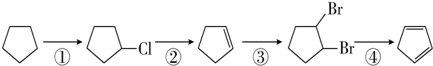
(1)其中,反应①的反应类型是取代反应,反应②的产物名称是环戊烯.工业上可由环戊二烯制备金刚烷(
 ),途径如下:
),途径如下: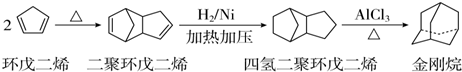
请回答下列问题:
(2)环戊二烯分子中最多有9个原子共平面;
(3)金刚烷的分子式为C10H16,其分子中的二氯代物有6种;
(4)A是二聚环戊二烯的同分异构体,属于芳香烃,其苯环上的一氯代物只有二种,能使溴的四氯化碳溶液褪色.符合以上信息的A的所有可能结构(不考虑立体异构)有6种,试写出苯环上支链最多的几种同分异构体的结构简式:
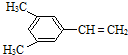 、
、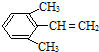 .
.
分析 (1)由合成路线可知,反应①为光照条件下的取代反应,反应②为消去反应,反应③为加成反应,反应④为消去反应;
(2)由碳碳双键为平面结构分析环戊二烯分子中最多共平面的原子数;
(3)金刚烷的分子中有6个CH2,4个CH结构,据此判断其分子式;金刚烷的结构可看做是由四个等同的六元环组成的空间构型,利用等效氢,先固定一个氯原子,再移动另一个氯原子,据此判断二氯代物的异构体数目;
(4)能使溴的四氯化碳溶液褪色,应含有碳碳双键,其苯环上的一氯代物只有二种,说明苯环上只有两种氢.
解答 解:(1)由合成路线可知,反应①为光照条件下的取代反应,其产物名称为氯代环戊烷;反应②卤素原子的消去反应,反应条件为氢氧化钠的醇溶液,生成物为环戊烯,故答案为:取代反应;环戊烯;
(2)C=C为平面结构,与双键碳直接相连的原子一定在同一平面内,则5个C和4个H在同一平面内,
故答案为:9;
(3)由C原子形成4个共价键,由结构简式可知金刚烷的分子中有6个CH2,4个CH结构,分子式为C10H16,金刚烷的结构可看作是由四个等同的六元环组成的空间构型,分子中含4个-CH-,6个-CH2,共2种位置的H,所以该物质的一氯代物有2种,当次甲基有一个氯原子取代后,二氯代物有3种,当亚甲基有一个氯原子取代后,二氯代物有3种,共6种;
故答案为:C10H16;6;
(4)能使溴的四氯化碳溶液褪色,应含有碳碳双键,所以可能的碳架结构为: 、
、 、
、 、
、 、
、 、
、 ,共6种,苯环上支链最多的几种同分异构体的结构简式:
,共6种,苯环上支链最多的几种同分异构体的结构简式: 和
和 ,
,
故答案为:6; 、
、 .
.
点评 本题考查有机物的合成,题目难度中等,注意把握有机物的官能团、碳链骨架等的变化,明确发生的反应及习题中的信息即可解答,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
10.下列事实一定能说明HF是弱酸的是( )
①1mol/L的HF水溶液能使紫色石蕊试液变红
②HF水溶液中存在HF分子
③稀释HF溶液时PH增大
④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体
⑥HF与水能以任意比混溶.
①1mol/L的HF水溶液能使紫色石蕊试液变红
②HF水溶液中存在HF分子
③稀释HF溶液时PH增大
④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体
⑥HF与水能以任意比混溶.
| A. | ①② | B. | ③⑤ | C. | ④⑥ | D. | ②④ |
11.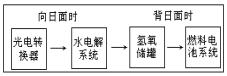 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中不正确的是( )
 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中不正确的是( )| A. | 该能量转化系统中的水也是可能循环的 | |
| B. | 燃料电池系统产生的能量实际上来自于水 | |
| C. | 水电解系统中的阳极有O2放出 | |
| D. | 燃料电池放电时的负极反应:H2+2OH--2e-=2H2O |
8.某白色粉末由两种物质组成,为鉴别其组成进行如下实验:①取少量样品加入适量蒸馏水得到澄清溶液;②向①所得的溶液中逐滴加入适量稀硫酸后出现浑浊.该白色粉末不可能是( )
| A. | Al2(SO4)3、NaOH | B. | Al2(NH3)2OH、KOH | C. | BaCl2、NaHCO3 | D. | Ca(ClO)2、NaHSO3 |
15.下列物质长期置于空气中质量不会增加的是( )
| A. | NaOH固体 | B. | 浓H2SO4 | C. | 碳酸钠晶体 | D. | Na2SO3溶液 |
8.下列指定反应的离子方程式正确的是( )
| A. | 用醋酸除去水垢中的碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 石灰水中加入过量小苏打溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| C. | 解饱和NaCl饱和溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| D. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O=AlO2-+2H2↑ |
15.在一定条件下,氯气可与氯化铵发生如下反应:xCl2+NH4Cl═yNClx+(x+y)HCl,当消耗6.72L标准状况下的Cl2时,生成0.100mol氮的氯化物,则此氮的氯化物的化学式为( )
| A. | NCl2 | B. | NCl3 | C. | NCl4 | D. | NCl5 |
12.甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙十丁→沉淀;乙+丁→无色无味气体.则甲、乙、丙、丁四种溶液依次是( )
| A. | BaCl2、Na2CO3、盐酸、AgNO3 | B. | Na2CO3、盐酸、AgNO3、BaCl2 | ||
| C. | BaCl2、Na2CO3、AgNO3、盐酸 | D. | AgNO3、盐酸、BaCl2、Na2CO3 |
13.在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1mol CO2和0.2mol CO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时c(CO2) 随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )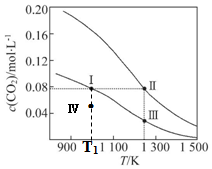

| A. | 该反应的△H>0、△S<0 | B. | 体系的总压强p:p (Ⅰ)>p (Ⅲ) | ||
| C. | 平衡常数:K(Ⅰ)>K (Ⅱ) | D. | T1K时,Ⅳ点所处的状态中 v(正)<v(逆) |