题目内容
4.某化学课外活动小组设计实验探究氮的化合物的性质,装置如图1所示,其中A(装置未画出)为气体发生装置. 检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯.部分实验现象如下:C处铂丝继续保持红热,F处铜片逐渐溶解.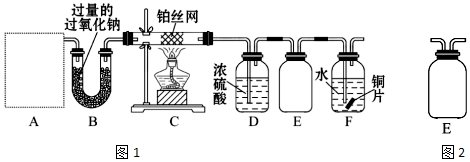
(1)实验室制取A中气体时若只用一种试剂,该试剂是A(填备选试剂的字母);
A.NH4HCO3B.NH4Cl C.Ca(OH)2 D.NaOH
此时A中主要的玻璃仪器有试管和酒精灯(填名称).
(2).对于C中发生的可逆反应,其方程式为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O有关该反应的下列说法中正确的是A.
A.增大一种反应物的浓度可以提高另一种反应物的转化率
B.工业上进行该反应时,可采取高压的条件提高反应物转化率
C.在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
(3)E装置可防止F中溶液倒吸进入D中,请在图2中画出装置E中的导气管.
(4)写出F中发生反应的离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;若进入F装置的物质成分和质量一定,可向F中加入下列物质(填字母)中的D使铜片溶解的质量增多.
A.Na2CO3 B.NaCl C.CuSO4 D.H2SO4.
分析 (1)根据题中信息推断装置A中产生的气体,然后根据要求判断药品;根据反应原理选择使用的仪器;
(2)C中发生反应为氨气和氧气在催化剂作用下发生氧化还原反应生成一氧化氮和水;
A.增大一种反应物的浓度,平衡向正反应方向移动;
B.增大压强,可使平衡向逆反应方向移动,转化率减小,且过高压强对设备的要求较高;
C.平衡浓度取决于起始物料比,平衡浓度关系不能确定;
(3)根据E的作用是防止F中溶液倒吸进入D分析导气管长短情况;
(4)铜和稀硝酸反应生成硝酸铜、一氧化氮和水,根据铜与稀硝酸反应的离子方程式判断氢离子和硝酸根离子消耗情况;
解答 解:(1)根据题意:C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯,铂丝继续保持红热,F处铜片逐渐溶解,说明有硝酸生成,所以A中获得的是氨气,实验室制取A中气体时若只用一种试剂,加热NH4HCO3或浓氨水都可以产生氨气,制取氨气反应中A装置均适用的玻璃仪器有试管和酒精灯,
故答案为:A;试管和酒精灯;
(2)C中氨气与氧气发生了氧化还原反应,反应的方程式为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O,
A.增大一种反应物的浓度,平衡向正反应方向移动,另一种物质的转化率增大,故A正确;
B.增大压强,可使平衡向逆反应方向移动,转化率减小,且过高压强对设备的要求较高,故B错误;
C.平衡浓度取决于起始物料比,平衡浓度关系不能确定,故C错误.
故答案为:A;
(3)由于E的作用是防止F中溶液倒吸进入D,所以连接D的导管不能够伸入集气瓶底部即可,如图: ,
,
故答案为: ;
;
(4)F中发生的反应是铜和稀硝酸的反应,反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,反应中消耗的氢离子物质的量大于硝酸根离子的物质的量,所以向溶液中只要加入氢离子,就可以溶解更多的铜,所以应该加入硫酸,故选D,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;D;
点评 本题主要考查学生氨气的化学性质,题目难度中等,结合实验的方式来考查,增大了难度,要求学生熟练掌握氨气的制法及化学性质,是高考中的常见题型,对学生的思维能力提出了较高的要求,充分考查了学生灵活应用所学知识解决实际问题的能力.

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案| A. | 苯中含有少量甲苯 | B. | 乙醇中含有少量乙酸 | ||
| C. | 溴苯中含有少量苯 | D. | 乙酸乙酯中含有少量乙酸 |
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致.则溶液呈黄色是含Br2(填化学式或离子符号,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:
A.酚酞试液 B.四氯化碳 C.无水酒精 D.硫氰化钾溶液
请写出丙同学的一种方案,选用的试剂及实验现象填在下表空格中.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案 | ①d或b | ②溶液变成血红色或下层的四氯化碳溶液依然无色 |
①在少量FeBr2溶液中通入足量Cl2,反应的离子方程式为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有$\frac{1}{3}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.
| A. | Na2O2固体中阳离子与阴离子的个数比为1:1 | |
| B. | 从试剂瓶中取出并切下的未使用的钠可放回原试剂瓶中 | |
| C. | 将Na投入饱和Na2CO3溶液中,会导致溶液质量增加 | |
| D. | 金属Na失火,可用CO2灭火 |
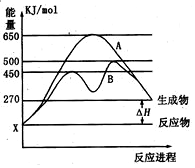 (1)已知:Fe(s)+$\frac{1}{2}$O2(g)=FeO(s),△H=-272.0KJ•mol-1
(1)已知:Fe(s)+$\frac{1}{2}$O2(g)=FeO(s),△H=-272.0KJ•mol-1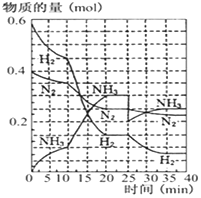 德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.
德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.