题目内容
10.0.1mol•L-1Na2CO3溶液中,c(CO32-)+c(HCO3-)+c(H2CO3)为( )| A. | 0.05mol•L-1 | B. | 0.1mol•L-1 | C. | 0.15mol•L-1 | D. | 0.2mol•L-1 |
分析 0.1mol•L-1Na2CO3溶液中,钠离子与C原子的总的物质的量一定相等,即一定满足物料守恒:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=c(Na+),据此进行计算.
解答 解:.1mol•L-1Na2CO3溶液中一定满足物料守恒:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=c(Na+),
则c(CO32-)+c(HCO3-)+c(H2CO3)=$\frac{1}{2}$c(Na+)=0.1mol/L×$\frac{1}{2}$=0.05mol/L,
故选A.
点评 本题考查了离子浓度大小比较,题目难度不大,明确物料守恒的含义为解答关键,注意掌握守恒思想在化学计算中的应用,试题侧重基础知识的考查,培养了学生的灵活应用能力

练习册系列答案
相关题目
18.除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法不正确的是( )
| 选项 | 待提纯的物质 | 选用试剂 | 操作的方法 |
| A | FeCl2溶液(FeCl3溶液) | 铁粉 | 过滤 |
| B | Al2O3(Fe2O3) | NaOH溶液和CO2 | 溶解、过滤、过滤 |
| C | Cl2(HCl) | 饱和食盐水 | 洗气 |
| D | Na2CO3固体(NaHCO3固体) | -- | 加热至质量不再变化 |
| A. | A | B. | B | C. | C | D. | D |
5.常温下,下列溶液的pH<7的是( )
| A. | Na2CO3 | B. | NaHCO3 | C. | NaClO | D. | NaHSO3 |
15.氢气和二氧化碳的混合气体通过足量Na2O2后,再将所得气体点燃恰好能完全反应,则下列关系式正确的是( )
| A. | V(H2):V(CO2)=2:1 | B. | V(H2):V(CO2)=1:4 | C. | V(H2):V(CO2)=1:1 | D. | V(H2):V(CO2)=1:2 |
5.某溶液中加入铝粉有氢气产生,该溶液中一定可以大量共存的离子组是( )
| A. | Na+、Fe3+、Cl-、ClO- | B. | Na+、K+、Ba2+、HCO3- | ||
| C. | Mg2+、NH4+、SO42-、Cl- | D. | Na+、K+、Cl-、SO42- |
2.已知:P4(g)+6Cl2(g)═4PCl3(g)△H=a kJ•mol-1,
P4(g)+10Cl2(g)═4PCl5(g)△H=b kJ•mol-1,
并知形成或拆开1mol化学键放出或吸收的能量称为该化学键的键能.P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ•mol-1,PCl3中P-Cl键的键能为1.2c kJ•mol-1.则Cl-Cl键的键能为( )
P4(g)+10Cl2(g)═4PCl5(g)△H=b kJ•mol-1,
并知形成或拆开1mol化学键放出或吸收的能量称为该化学键的键能.P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ•mol-1,PCl3中P-Cl键的键能为1.2c kJ•mol-1.则Cl-Cl键的键能为( )
| A. | (b-a)/4 kJ•mol-1 | B. | (b-a+1.4c)/4 kJ•mol-1 | ||
| C. | (b-a+5.6c)/4 kJ•mol-1 | D. | b-a+1.4c kJ•mol-1 |
3. 亚氯酸钠是一种高效氧化型漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是毒性很大的气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).在25℃时,下列分析正确的是( )
亚氯酸钠是一种高效氧化型漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是毒性很大的气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).在25℃时,下列分析正确的是( )
 亚氯酸钠是一种高效氧化型漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是毒性很大的气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).在25℃时,下列分析正确的是( )
亚氯酸钠是一种高效氧化型漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是毒性很大的气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).在25℃时,下列分析正确的是( )| A. | 使用该漂白剂的最佳pH为3 | |
| B. | pH=5时,溶液中$\frac{c(Cl{{O}_{2}}^{-})}{c(HCl{O}_{2})}$=$\frac{1}{10}$ | |
| C. | pH=6时,NaClO2溶液中:c(Na+)+c( H+)=c( ClO2-)+c( OH-) | |
| D. | NaClO2溶液加水稀释所有离子浓度均减小 |
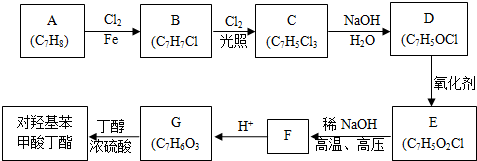 对羟基甲苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得.:
对羟基甲苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得.: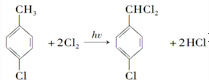 ,
, ;
;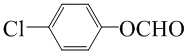 (写结构简式).
(写结构简式).