题目内容
 今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液作为试液,分别进行如图实验:根据实验,以下推测判断不正确的是( )
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液作为试液,分别进行如图实验:根据实验,以下推测判断不正确的是( )| A、一定存在NH4+,一定不存在K+ |
| B、混合溶液中c(CO32-)为0.1mol/L |
| C、Cl-可能存在 |
| D、Ba2+、Mg2+一定不存在 |
考点:物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:①加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
②与NaOH溶液加热生成的气体为氨气,溶液中一定含有NH4+;
③4.66g沉淀为硫酸钡,6.63g为硫酸钡和碳酸钡,则溶液中一定含CO32-、SO42-,以此来解答.
②与NaOH溶液加热生成的气体为氨气,溶液中一定含有NH4+;
③4.66g沉淀为硫酸钡,6.63g为硫酸钡和碳酸钡,则溶液中一定含CO32-、SO42-,以此来解答.
解答:
解:①加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
②与NaOH溶液加热生成的气体为氨气,溶液中一定含有NH4+;
③4.66g沉淀为硫酸钡,6.63g为硫酸钡和碳酸钡,则溶液中一定含CO32-、SO42-,
A.由上述分析可知一定存在NH4+,不能确定是否存在K+,故A错误;
B.碳酸钡的质量为6.63g-4.66g=1.97g,物质的量为
=0.01mol,混合溶液中c(CO32-)为
=0.1mol/L,故B正确;
C.由上述分析可知,Cl-可能存在,故C正确;
D.一定存在CO32-、SO42-,则Ba2+、Mg2+一定不存在,故D正确;
故选A.
②与NaOH溶液加热生成的气体为氨气,溶液中一定含有NH4+;
③4.66g沉淀为硫酸钡,6.63g为硫酸钡和碳酸钡,则溶液中一定含CO32-、SO42-,
A.由上述分析可知一定存在NH4+,不能确定是否存在K+,故A错误;
B.碳酸钡的质量为6.63g-4.66g=1.97g,物质的量为
| 1.97g |
| 197g/mol |
| 0.01mol |
| 0.1L |
C.由上述分析可知,Cl-可能存在,故C正确;
D.一定存在CO32-、SO42-,则Ba2+、Mg2+一定不存在,故D正确;
故选A.
点评:本题考查物质检验实验方案的设计,为高频考点,把握实验中发生的反应、现象与结论的关系为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
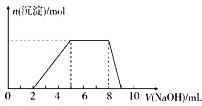 某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、[Al(OH)4]-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、[Al(OH)4]-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )| A、原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+ |
| B、反应最后形成的溶液中的溶质含AlCl3 |
| C、原溶液中Al3+与NH4+的物质的量之比为1:3 |
| D、原溶液中含有的阴离子是[Al(OH)4]-、Cl- |
配置100mL 1.0mol/L CuSO4溶液,下列有关说法正确的( )
| A、可选用250mL的容量瓶来配置 |
| B、配置过程中需要到胶头滴管 |
| C、用托盘天平称量溶质时,称量前指针向左偏,未调平即开始称量溶质,所配得的CuSO4溶液的浓度偏高 |
| D、需称取16g CuSO4?5H2O |
 在一个10L的密闭恒定温度的容器中加入1.0mol Z、1.0mol X、0mol Y开始反应,X、Y、Z三种物质物质的量随时间变化关系如图,在5min时Z、X、Y物质的量分别是0.1mol、0.7mol、0.6mol,下列说法正确的是( )
在一个10L的密闭恒定温度的容器中加入1.0mol Z、1.0mol X、0mol Y开始反应,X、Y、Z三种物质物质的量随时间变化关系如图,在5min时Z、X、Y物质的量分别是0.1mol、0.7mol、0.6mol,下列说法正确的是( )| A、前5min内,Z的平均反应速率是0.9 mol/(L?s) |
| B、该反应的化学方程式可表达式:2Y=3Z+X |
| C、在第2min时,Y和Z的物质的量浓度相等,表明反应处于平衡状态 |
| D、第5min后,X、Y、Z的浓度保持不变,正反应速率等于逆反应速率 |
下列化合物中,既有离子键,又有共价键的是( )
| A、Na2O2 |
| B、NH3 |
| C、H2SO4 |
| D、MgCl2 |
下列离子方程式正确的是( )
| A、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、硫酸铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
| C、将氯气通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl- |
| D、金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ |
目前消耗叙利亚化学武器工作正逐步展开.芥子气(分子式:C4H8Cl2S)是一种糜烂性毒剂,它属于( )
| A、单质 | B、有机物 |
| C、混合物 | D、硫酸盐 |
成语言简意赅,是中华民族智慧的结晶.下列成语描绘的变化属于化学变化的是( )
| A、冰雪消融 | B、木已成舟 |
| C、蜡炬成灰 | D、沙里淘金 |