题目内容
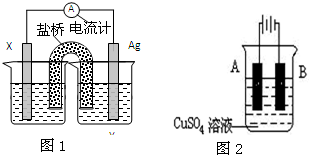 (Ⅰ)依据氧化还原反应:2Ag+(aq)+Fe(s)=Fe2+(aq)+2Ag(s)设计的原电池如图1所示.
(Ⅰ)依据氧化还原反应:2Ag+(aq)+Fe(s)=Fe2+(aq)+2Ag(s)设计的原电池如图1所示.请回答下列问题:
(1)电极X的材料是
(2)X电极上发生的电极反应为
(3)盐桥中的阳离子移动的方向是
(Ⅱ)钢铁工业是国家工业的基础.请回答钢铁腐蚀、防护过程中的有关问题.
(1)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3?x H2O),反应的化学方程式为:4Fe+3O2+xH2O═2Fe2O3.xH2O.生产中可用盐酸来除铁锈.现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式
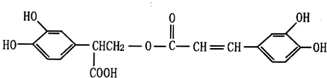
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置示意图如图2:请回答:
①A电极对应的金属是
②若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(I)由方程式2Ag+(aq)+Fe(s)=Fe2+(aq)+2Ag(s)可知,反应中Ag+被还原,应为正极反应,则电解质溶液为硝酸银溶液,Fe被氧化,应为原电池负极反应,在装置图中X为Fe,Y为硝酸银溶液,以此解答该题.
(II)(1)铁锈的成分是Fe2O3?xH2O,能和盐酸反应生成氯化铁和水,铁和氯化铁发生氧化还原反应生成氯化亚铁;
(2)①电镀时,镀层作阳极,镀件作阴极;
②电镀时,阳极上金属失电子导致金属质量减少,阴极上析出金属,导致质量增加,电镀后两极质量差的一半为阴极上析出的铜质量,根据析出铜质量和转移电子之间的关系式计算.
(II)(1)铁锈的成分是Fe2O3?xH2O,能和盐酸反应生成氯化铁和水,铁和氯化铁发生氧化还原反应生成氯化亚铁;
(2)①电镀时,镀层作阳极,镀件作阴极;
②电镀时,阳极上金属失电子导致金属质量减少,阴极上析出金属,导致质量增加,电镀后两极质量差的一半为阴极上析出的铜质量,根据析出铜质量和转移电子之间的关系式计算.
解答:
解:(I)由方程式2Ag+(aq)+Fe(s)=Fe2+(aq)+2Ag(s)可知,反应中Ag+被还原,应为正极反应,则电解质溶液为硝酸银溶液,Fe被氧化,应为原电池负极反应,在装置图中X为Fe,Y为硝酸银溶液,
(1)电极X的材料是 Fe;电解质溶液Y是AgNO3溶液;故答案为:Fe;AgNO3溶液;
(2)X为Fe,Fe失电子被氧化生成亚铁离子,其电解反应为:Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
(3)溶液中阳离子向正极移动,所以盐桥中的阳离子移动的方向是移向Y;故答案为:移向Y;
(II)(1)铁锈的成分是Fe2O3?xH2O,能和盐酸反应生成氯化铁和水,氯化铁具有氧化性,能和铁发生氧化还原反应生成氯化亚铁,
反应方程式为2FeCl3+Fe═3FeCl2,
故答案为:2FeCl3+Fe═3FeCl2;
(5)①在铁上镀铜时,铜作阳极连接原电池正极,铁作阴极连接原电池负极,所以A为铜,B为铁,铁电极上铜离子得电子生成铜单质,
电极反应式为 Cu2++2e-═Cu,
故答案为:铜;Cu2++2e-═Cu;
②电镀时,阳极上金属失电子导致金属质量减少,阴极上析出金属,导致质量增加,电镀后两极质量差的一半为阴极上析出的铜质量,
所以阴极上析出铜的质量=5.12g×
=2.56g,转移电子的物质的量=
=0.08 mol,
故答案为:0.08.
(1)电极X的材料是 Fe;电解质溶液Y是AgNO3溶液;故答案为:Fe;AgNO3溶液;
(2)X为Fe,Fe失电子被氧化生成亚铁离子,其电解反应为:Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
(3)溶液中阳离子向正极移动,所以盐桥中的阳离子移动的方向是移向Y;故答案为:移向Y;
(II)(1)铁锈的成分是Fe2O3?xH2O,能和盐酸反应生成氯化铁和水,氯化铁具有氧化性,能和铁发生氧化还原反应生成氯化亚铁,
反应方程式为2FeCl3+Fe═3FeCl2,
故答案为:2FeCl3+Fe═3FeCl2;
(5)①在铁上镀铜时,铜作阳极连接原电池正极,铁作阴极连接原电池负极,所以A为铜,B为铁,铁电极上铜离子得电子生成铜单质,
电极反应式为 Cu2++2e-═Cu,
故答案为:铜;Cu2++2e-═Cu;
②电镀时,阳极上金属失电子导致金属质量减少,阴极上析出金属,导致质量增加,电镀后两极质量差的一半为阴极上析出的铜质量,
所以阴极上析出铜的质量=5.12g×
| 1 |
| 2 |
| 2.56g |
| 64g/mol |
故答案为:0.08.
点评:本题考查了原电池的设计、原电池和电解池原理的应用等知识点,根据电镀原理、金属的腐蚀与防护来分析解答即可,题目难度中等.

练习册系列答案
相关题目
下列图象表达正确的是( )
A、 浓硫酸的稀释 |
B、 过量的盐酸与等量的锌粉反应 |
C、 氢气与氧气反应中的能量变化 |
D、 微粒电子数 |
过量锌粉与200mL 5mol?L-1H2SO4反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量( )
| A、水 |
| B、NaOH溶液 |
| C、K2CO3溶液 |
| D、NaNO3溶液 |
A、B、C 3种元素的核外电子数都比氩原子少,若A和C处于同一主族,A和B的核电荷数之差为5,B原子的M电子层比L电子层少2个电子,则A、B、C 3种元素可能分别为( )
| A、Li、Na、S |
| B、Na、S、Li |
| C、Na、K、Br |
| D、K、Br、Na |
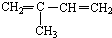 与Br2按物质的量之比1:1发生1,4加成反应方程式
与Br2按物质的量之比1:1发生1,4加成反应方程式