题目内容
X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
(1)R的离子结构示意图是 ,R在自然界中有质量数为35和37的两种核素,它们之间的关系互为 .
(2)M元素的常见单质有二种,它们互称同素异形体,它们的化学式为 、 .
(3)Z的单质与水反应的化学方程式是 .
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 可做半导体材料 | 焰色反应呈黄色 |
(2)M元素的常见单质有二种,它们互称同素异形体,它们的化学式为
(3)Z的单质与水反应的化学方程式是
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X阳离子核外无电子,则应为H元素,Y主要化合价有-4,+4,应为第ⅣA族元素,可做半导体材料,应为Si,Z焰色反应呈黄色,为Na元素,M的最低化合价为-2价,R的化合价为-1价,应分别为ⅥA、ⅦA族元素,Z的原子半径较小,说明M为O,R为Cl,Q的最高化合价为+3价,应为ⅢA族元素,原子半径比Z小,应为Al,结合题目要求解答该题.
解答:
解:X阳离子核外无电子,则应为H元素,Y主要化合价有-4,+4,应为第ⅣA族元素,可做半导体材料,应为Si,Z焰色反应呈黄色,为Na元素,M的最低化合价为-2价,R的化合价为-1价,应分别为ⅥA、ⅦA族元素,Z的原子半径较小,说明M为O,R为Cl,Q的最高化合价为+3价,应为ⅢA族元素,原子半径比Z小,应为Al,
(1)R为Cl,离子核外有3个电子层,最外层电子数为8,结构示意图为,Cl在自然界中有质量数为35和37的两种核素,它们之间的关系互为同位素,
故答案为: ;同位素;
;同位素;
(2)M为O元素,常见单质有二种,它们互称同素异形体,分别为O2、O3,故答案为:O2;O3;
(3)Z为Na,与水反应生成NaOH和氢气,反应的方程式为2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑.
(1)R为Cl,离子核外有3个电子层,最外层电子数为8,结构示意图为,Cl在自然界中有质量数为35和37的两种核素,它们之间的关系互为同位素,
故答案为:
 ;同位素;
;同位素;(2)M为O元素,常见单质有二种,它们互称同素异形体,分别为O2、O3,故答案为:O2;O3;
(3)Z为Na,与水反应生成NaOH和氢气,反应的方程式为2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑.
点评:本题考查结构性质位置关系应用,为高频考点,侧重于学生的分析能力的考查,难度不大,涉及电子式、原子结构示意图、元素周期律、物质分类等,有利于考查学生的分析归纳能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
有关电解质的说法正确的是( )
| A、FeCl3溶液能够导电,所以FeCl3溶液是电解质 |
| B、CO2水溶液能够导电,所以CO2是电解质 |
| C、液态的铜导电性很好,所以铜是电解质 |
| D、NaOH固体溶于水后能导电,所以NaOH是电解质 |
下列有关化学用语使用正确的是( )
A、CH4分子的比例模型: |
| B、乙醇的分子式CH3CH2OH |
| C、苯的最简式 C6H6 |
| D、乙烯的结构简式CH2CH2 |
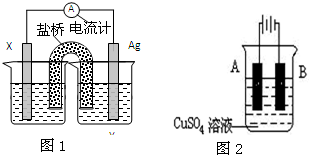 (Ⅰ)依据氧化还原反应:2Ag+(aq)+Fe(s)=Fe2+(aq)+2Ag(s)设计的原电池如图1所示.
(Ⅰ)依据氧化还原反应:2Ag+(aq)+Fe(s)=Fe2+(aq)+2Ag(s)设计的原电池如图1所示.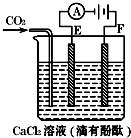 如图为持续电解含一定CaCl2水溶液的装置(以铂为电极),A为电流表.电解一段时间t1后,将CO2持续通入电解液中.
如图为持续电解含一定CaCl2水溶液的装置(以铂为电极),A为电流表.电解一段时间t1后,将CO2持续通入电解液中.