题目内容
已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(CH3COO-)>c(Na+)>c(H+)>c(OH-) B.c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.c(CH3COO-)>c(H+)>c(Na+)>c(OH-) D.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
(1)这四组关系中有一组是不可能的,这组关系是 (选填序号).
(2)若该溶液只有一种溶质,上述离子浓度大小顺序关系中正确的是(选填序号) .
(3)若上述关系中C是正确的,则溶液中溶质的化学式是 .
(4)若该溶液由体积相等的醋酸和NaOH溶液混合而成,且恰好呈中性,则:混合前c(CH3COOH) c(NaOH)(填“>”、“<”、或“=”,下同);混合后溶液中c(Na+) c(CH3COO-).
A.c(CH3COO-)>c(Na+)>c(H+)>c(OH-) B.c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.c(CH3COO-)>c(H+)>c(Na+)>c(OH-) D.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
(1)这四组关系中有一组是不可能的,这组关系是
(2)若该溶液只有一种溶质,上述离子浓度大小顺序关系中正确的是(选填序号)
(3)若上述关系中C是正确的,则溶液中溶质的化学式是
(4)若该溶液由体积相等的醋酸和NaOH溶液混合而成,且恰好呈中性,则:混合前c(CH3COOH)
考点:离子浓度大小的比较,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,溶质可能是氢氧化钠和醋酸钠、醋酸钠、醋酸钠和醋酸;
(1)溶液中必须满足电荷守恒,根据电荷守恒对各选项进行判断;
(2)只有一种溶质时,溶质为醋酸钠,根据醋酸根离子水解进行分析;
(3)若上述关系中C是正确的,溶液呈酸性,且c(CH3COO-)>c(Na+),则溶液中的溶质是醋酸钠和醋酸;
(4)若醋酸与氢氧化钠等体积、等浓度混合,溶液显示碱性,则醋酸的浓度应该稍大;混合溶液呈中性,则c(H+)=c(OH-),再结合电荷守恒判断混合后的溶液中醋酸根离子与钠离子的浓度关系.
(1)溶液中必须满足电荷守恒,根据电荷守恒对各选项进行判断;
(2)只有一种溶质时,溶质为醋酸钠,根据醋酸根离子水解进行分析;
(3)若上述关系中C是正确的,溶液呈酸性,且c(CH3COO-)>c(Na+),则溶液中的溶质是醋酸钠和醋酸;
(4)若醋酸与氢氧化钠等体积、等浓度混合,溶液显示碱性,则醋酸的浓度应该稍大;混合溶液呈中性,则c(H+)=c(OH-),再结合电荷守恒判断混合后的溶液中醋酸根离子与钠离子的浓度关系.
解答:
解:某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,溶质可能是氢氧化钠和醋酸钠、醋酸钠、醋酸钠和醋酸;
(1)溶液中一定满足电荷守恒,四组关系中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)不满足电荷守恒,所以B中离子浓度关系是不可能的,
故答案为:B;
(2)若只有1种溶质,则溶质只能为CH3COONa溶液,用于醋酸根离子水解、钠离子不水解,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(CH3COO-),醋酸根离子水解程度较小,所以c(CH3COO-)>c(OH-),所以溶液中离子浓度大小顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),则D正确,
故答案为:D;
(3)若上述关系中C正确,则溶液呈酸性,溶液中c(CH3COO-)>c(Na+),溶液中的溶质只能为CH3COOH和CH3COONa,
故答案为:CH3COOH和CH3COONa;
(4)等体积、等浓度的醋酸与氢氧化钠溶液反应,生成的溶质为醋酸钠,溶液显示碱性,若要显示中性,则加入的醋酸应该过量,即混合前c(CH3COOH)>c(NaOH);
由于混合液呈中性,则c(H+)=c(OH-),根据电荷守恒可得:c(CH3COO-)=c(Na+),
故答案为:>;=.
(1)溶液中一定满足电荷守恒,四组关系中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)不满足电荷守恒,所以B中离子浓度关系是不可能的,
故答案为:B;
(2)若只有1种溶质,则溶质只能为CH3COONa溶液,用于醋酸根离子水解、钠离子不水解,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(CH3COO-),醋酸根离子水解程度较小,所以c(CH3COO-)>c(OH-),所以溶液中离子浓度大小顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),则D正确,
故答案为:D;
(3)若上述关系中C正确,则溶液呈酸性,溶液中c(CH3COO-)>c(Na+),溶液中的溶质只能为CH3COOH和CH3COONa,
故答案为:CH3COOH和CH3COONa;
(4)等体积、等浓度的醋酸与氢氧化钠溶液反应,生成的溶质为醋酸钠,溶液显示碱性,若要显示中性,则加入的醋酸应该过量,即混合前c(CH3COOH)>c(NaOH);
由于混合液呈中性,则c(H+)=c(OH-),根据电荷守恒可得:c(CH3COO-)=c(Na+),
故答案为:>;=.
点评:本题考查了离子浓度大小比较、盐的水解原理,题目难度中等,注意明确判断溶液中离子浓度大小的方法,能够根据电荷守恒、盐的水解正确比较溶液中各离子浓度关系.

练习册系列答案
相关题目
C4H10在光照条件下与氯气发生取代反应可生成C4H9Cl,C4H8Cl2等一系列氯代烃,下列有关叙述中正确的是( )
| A、C4H10的同分异构体共有3种 |
| B、C4H9Cl的同分异构体共有3种 |
| C、C4H8Cl2的同分异构体共有6种 |
| D、生成的氯代烃中可能含有CH(CCl3)3 |
雷雨天N2会发生一系列的反应,电闪雷鸣的雨天,一般不可能生成的是( )
| A、NH3 |
| B、HNO3 |
| C、NO2 |
| D、NO |
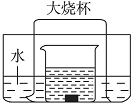 如图所示的实验装置,向盛有足量水的水槽里放两个烧杯,小烧杯里放有适量的铜片和过量的浓硝酸,小烧杯外面倒扣一个大烧杯,请回答下列问题:
如图所示的实验装置,向盛有足量水的水槽里放两个烧杯,小烧杯里放有适量的铜片和过量的浓硝酸,小烧杯外面倒扣一个大烧杯,请回答下列问题: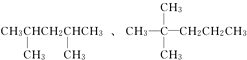
 一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示: