题目内容
将57.2g表面已锈蚀成铜绿【Cu2(OH)2CO3】的铜片投入120mL一定浓度的硝酸中,充分反应后,硝酸被还原成NO2和NO气体共8.064L(标准状况下),测得反应后溶液中c(H+)=1.0mol?L-1(假设反应前后溶液的体积不变).往反应后的溶液中加入过量NaOH溶液,滤出沉淀,经洗涤、干燥后称得质量为58.8g.则原硝酸的物质的量浓度为( )
| A、9.0 mol?L-1 |
| B、10.0 mol?L-1 |
| C、13.0 mol?L-1 |
| D、14.0 mol?L-1 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:干燥后得到58.8g蓝色固体为Cu(OH)2,n(Cu(OH)2)=
=0.6mol,根据的物质的量可知样品中Cu的物质的量,再根据N元素守恒计算.
| 58.8g |
| 98g/mol |
解答:
解:干燥后得到58.8g蓝色固体为Cu(OH)2,n(Cu(OH)2)=
=0.6mol,根据Cu元素守恒,n(Cu)=0.6mol,
设单质铜为xmol,Cu2(OH)2CO3为ymol,则
解得x=0.2,y=0.2,
原硝酸的物质的量为:n=2n(Cu(NO3)2)+n(HNO3)余+n(NOx)=2×0.6mol+1mol/L×0.12L+
=1.68mol,
c(HNO3)=
=14.0 mol?L-1,故选D.
| 58.8g |
| 98g/mol |
设单质铜为xmol,Cu2(OH)2CO3为ymol,则
|
解得x=0.2,y=0.2,
原硝酸的物质的量为:n=2n(Cu(NO3)2)+n(HNO3)余+n(NOx)=2×0.6mol+1mol/L×0.12L+
| 8.064L |
| 22.4L/mol |
c(HNO3)=
| 1.68mol |
| 0.12L |
点评:本题考查混合物的计算,题目难度不大,本题注意从质量的角度结合化学方程式计算,本题用到的守恒有质量守恒、电子守恒,并用到了端值法,在做题时要用心体会.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
X、Y为两种元素的原子,X-与Y+具有相同的电子层结构,由此可知( )
| A、X的原子半径大于Y的原子半径 |
| B、X的电负性大于Y的电负性 |
| C、X-的半径大于Y+的半径 |
| D、X的第一电离能小于Y的第一电离能 |
下面的叙述中不正确的是( )
| A、在熔化和溶于水时均不导电的化合物叫非电解质 |
| B、电解质、非电解质都一定是化合物,单质不属于此范畴 |
| C、电解质放在水中一定能导电,非电解质放在水中一定不导电 |
| D、导电能力强的电解质不一定是强电解质,导电能力弱的不一定是弱电解质 |
下列反应的离子方程式正确的是( )
| A、向澄清石灰水中滴加盐酸:Ca(OH)2+2H+=Ca2++2H2O |
| B、向铜粉中加入稀H2SO4:Cu+2H+=Cu2++H2↑ |
| C、向CuSO4溶液中加入Fe粉:Fe+Cu2+=Fe2++Cu |
| D、向AgNO3溶液中加入Cu粉:Ag++Cu=Cu2++Ag |
分别向下列各溶液中加入少量NaOH固体,溶液的导电能力变化不大的是 ( )
| A、自来水 |
| B、NaCl溶液 |
| C、醋酸溶液 |
| D、HCl溶液 |
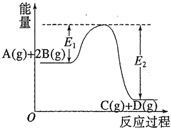 反应A(g)+2B(g)?C(g)+D(g)过程中的能量变化如图所示,有关叙述正确的是( )
反应A(g)+2B(g)?C(g)+D(g)过程中的能量变化如图所示,有关叙述正确的是( )| A、该反应是吸热反应 |
| B、当反应达到平衡时,升高温度,A的转化率增大 |
| C、反应体系中加入催化剂对反应热无影响 |
| D、在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 |
下列各组物质的反应,能用H++OH-=H2O表示的是( )
| A、硫酸和氢氧化钡溶液 |
| B、盐酸和烧碱溶液 |
| C、硫酸和氢氧化铜 |
| D、盐酸和氢氧化铁 |
某气态烃0.5mol能与1mol氯化氢完全加成,加成后的产物分子上的氢原子最多可被3mol氯气取代,则此气态烃可能是( )
| A、CH2=CH2 |
| B、CH2=C(CH3)-CH3 |
| C、CH≡CH |
| D、CH≡C-CH3 |
 在某有机物A的分子中,具有酚羟基、醇羟基、羟基等官能团,其结构简式如图.
在某有机物A的分子中,具有酚羟基、醇羟基、羟基等官能团,其结构简式如图.