题目内容
1.如图1的实线表示元素周期表的部分边界. ①~⑤分别表示元素周期表中对应位置的元素.(1)③④⑤的氢化物稳定性由强到弱的顺序是HF>H2O>H2S (用化学式表示).
(2)写出②含有12个中子的核素的化学符号2311Na
(3)M、N两种化合物均由①②③④四种元素组成,写出此两种化合物在水溶液中发生反应的离子方程式H++HSO3-═SO2↑+H2O.
(4)X、Y、Z代表原子序数依次增大的三种短周期元素.在周期表中,Y与X相邻,Y与Z也相邻;X、Y和Z三种元素原子的最外层电子数之和为17;X、Y、Z三种元素有的是上表中编号①~⑤的元素,有的不是,不是①~⑤的元素在周期表中的位置为第二周期第VA族.X、Y、Z和①可组成一化合物,其原子个数比为2﹕4﹕1﹕8,该化合物所含化学键类型为离子键和共价键
(5)某同学受镧系、锕系元素排列方式的启发,将元素周期表设计成下列更简明的形式,把118种元素全部排列在内,图2除A、B、C、D外每个位置只表示一种元素.则该图的A位置包含11(填数字)种元素.C位置中的元素是否全部是金属元素是(填“是”或“否”).

分析 根据元素周期表图1知,①~⑤分别为H、Na、O、F、S元素;
(1)元素的非金属性越强,其氢化物的稳定性越强;
(2)②是Na元素,该元素原子核内有11个质子、12个中子,其质量数是23;
(3)M、N两种化合物均由①②③④四种元素组成,这两种化合物在水溶液中能发生反应,则分别是硫酸氢钠、亚硫酸氢钠,二者反应生成二氧化硫和水;
(4)X、Y、Z代表原子序数依次增大的三种短周期元素,在周期表中,Y与X相邻,Y与Z也相邻,假设Y、Z、W处于同一周期,根据它们的原子序数依次增大,其最外层电子数分别设为x-1、x、x+1,则x-1+x+x+1=17,x为分数,不合理,假设不成立,三者不能处于同一周期,处于不同周期的Y、Z、W两两相邻,可能出现的位置关系有: ,设X的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,X、Y、Z对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,x为分数,不合理;X、Y、Z和①可组成一化合物,其原子个数比为2﹕4﹕1﹕8,该化合物为硫酸铵,铵根离子和酸根离子之间存在离子键、N-H及S-O原子之间存在共价键;
,设X的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,X、Y、Z对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,x为分数,不合理;X、Y、Z和①可组成一化合物,其原子个数比为2﹕4﹕1﹕8,该化合物为硫酸铵,铵根离子和酸根离子之间存在离子键、N-H及S-O原子之间存在共价键;
(5)第四周期共有18种元素,而表中共有8个纵行,故A位置包含11种元素;C位于第六周期全部为金属元素.
解答 解:根据元素周期表图1知,①~⑤分别为H、Na、O、F、S元素;
(1)元素的非金属性越强,其氢化物的稳定性越强,非金属性F>O>S,所以氢化物的稳定性强弱顺序是HF>H2O>H2S,故答案为:HF>H2O>H2S;
(2)②是Na元素,该元素原子核内有11个质子、12个中子,其质量数是23,该原子符号为2311Na
,故答案为:2311Na;
(3)M、N两种化合物均由①②③④四种元素组成,这两种化合物在水溶液中能发生反应,则分别是硫酸氢钠、亚硫酸氢钠,二者反应生成二氧化硫和水,离子方程式为H++HSO3-═SO2↑+H2O,
故答案为:H++HSO3-═SO2↑+H2O;
(4)X、Y、Z代表原子序数依次增大的三种短周期元素,在周期表中,Y与X相邻,Y与Z也相邻,假设Y、Z、W处于同一周期,根据它们的原子序数依次增大,其最外层电子数分别设为x-1、x、x+1,则x-1+x+x+1=17,x为分数,不合理,假设不成立,三者不能处于同一周期,处于不同周期的Y、Z、W两两相邻,可能出现的位置关系有: ,设X的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,X、Y、Z对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,x为分数,不合理,不是编号①~⑤的元素为N元素,处于第二周VA族;X、Y、Z和①可组成一化合物,其原子个数比为2﹕4﹕1﹕8,该化合物为硫酸铵,铵根离子和酸根离子之间存在离子键、N-H及S-O原子之间存在共价键,所以该化合物中存在离子键和共价键,
,设X的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,X、Y、Z对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,x为分数,不合理,不是编号①~⑤的元素为N元素,处于第二周VA族;X、Y、Z和①可组成一化合物,其原子个数比为2﹕4﹕1﹕8,该化合物为硫酸铵,铵根离子和酸根离子之间存在离子键、N-H及S-O原子之间存在共价键,所以该化合物中存在离子键和共价键,
故答案为:第二周期第ⅤA族;离子键、共价键;
(5)第四周期共有18种元素,而表中共有8个纵行,第四周期除A外每个位置只表示一种元素,故A位置包含11种元素;C位于第六周期全部为金属元素;
故答案为:11;是.
点评 本题考查学生元素周期表和元素周期律的综合知识,要求学生具有分析和解决问题的能力,明确元素周期表结构及元素在周期表中的位置是解本题关键,把握正确的解题思路及方法,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 8个中子的碳原子的核素符号:12C | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 氢氧根离子的电子式: | D. | Cl-离子结构示意图: |
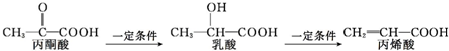
下列叙述错误的是( )
| A. | 三种有机物中都存在2种官能团 | |
| B. | 乳酸和丙烯酸都能使高锰酸钾酸性溶液褪色 | |
| C. | 1 mol乳酸最多能与2 mol Na发生反应 | |
| D. | 三种有机物均能发生聚合反应生成高分子化合物 |
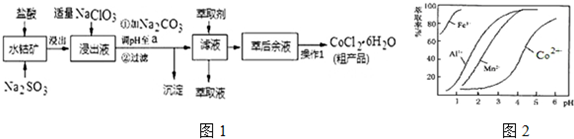
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
| A. | 硅酸钠溶液 | B. | 氢氟酸 | C. | 蔗糖溶液 | D. | 氯化钠溶液 |
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的总反应式可表述为Zn+2NH4++2MnO2═Zn2++2NH3+2MnO(OH).则对应的正极反应式应为MnO2+e-+NH4+=MnO(OH)+NH3,MnO(OH)中锰元素的化合价为+3价.
(2)维持电流强度为0.5A,电池工作五分钟,理论消耗锌0.05g.(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,若将滤液加热蒸发,首先应该析出的物质应是NH4Cl,原因是同温下它的溶解度远小于ZnCl2;滤渣的主要成分是MnO2、MnO(OH)和碳粉.
(3)废电池的锌皮中有少量杂质铁、将其加入稀硫酸溶解,再加入双氧水,加碱调节pH可得到Fe(OH)3沉淀.加入双氧水时发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;铁离子开始沉淀时的溶液的pH应为(假定Fe3+为0.01mol•L-1)2;若上述过程不加双氧水就加碱调节pH,直接得到的沉淀中应主要含有Zn(OH)2和Fe(OH)2.
| A. | 食醋 | B. | 白酒 | C. | 食盐 | D. | 葡萄糖 |
| A. | 用湿润的淀粉碘化钾试纸检验是否有Cl- | |
| B. | 用托盘天平称取12.6g Na2SO4固体粉末 | |
| C. | 通过分液方法分离酒精和水 | |
| D. | 将250g Cu2SO4•5H2O固体溶于1L水,配制1 mol•L-1 CuSO4溶液 |