题目内容
如图①所示为血红蛋白和肌红蛋白的活性部分--血红素的结构式.
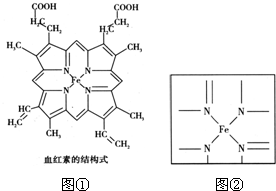
回答下列问题:
(1)已知铁是26号元素,写出Fe的价层电子排布式 ;在元素周期表中,该元素在 区(填“s”、“p”、“d”、“f”或“ds”).
(2)血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是 ; 血红素中N原子的杂化方式为 ;请在如图②的方框内用“→”标出Fe2+的配位键 (如果考生选做此题,请自行将图②画在答题卡上).
(3)Fe原子或离子能与一些分子或离子形成配合物.Fe(CO)5是一种常见含Fe配合物,可代替四乙基铅作为汽油的抗爆震剂,其配体是CO分子.写出CO的一种常见等电子体分子的结构式 ;两者相比较,沸点较高的是 (填分子式).Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)═Fe(s)+5CO(g)反应过程中,断裂的化学键只有配位键,形成的化学键类型是 .
(4)铁有α、γ、δ三种同素异形体,其晶胞如图所示,在三种晶体中最邻近的铁原子间距离相同.图2晶胞中所含有的铁原子数为 ,图1和图3中,铁原子配位数之比为 .


回答下列问题:
(1)已知铁是26号元素,写出Fe的价层电子排布式
(2)血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是
(3)Fe原子或离子能与一些分子或离子形成配合物.Fe(CO)5是一种常见含Fe配合物,可代替四乙基铅作为汽油的抗爆震剂,其配体是CO分子.写出CO的一种常见等电子体分子的结构式
(4)铁有α、γ、δ三种同素异形体,其晶胞如图所示,在三种晶体中最邻近的铁原子间距离相同.图2晶胞中所含有的铁原子数为

考点:原子轨道杂化方式及杂化类型判断,元素电离能、电负性的含义及应用,化学键,配合物的成键情况,“等电子原理”的应用,晶胞的计算
专题:化学键与晶体结构
分析:(1)根据构造原理写出基态铁原子核外电子排布式,根据Fe在周期表中的位置判断;
(2)同一周期元素的第一电离能随着原子序数的增大而增大,但第五主族元素的第一电离能大于第六主族元素的;根据每个N原子含有的σ 键个数与孤电子对数之和判断其杂化方式;配位键由提供孤电子对的原子指向提供空轨道的原子;
(3)由等电子体定义可知CO的一种常见等电子体为氮气,CO为极性分子熔点高;断裂配位键后,配体变为CO,中心原子结合成金属晶体;
(4)利用均摊法计算γ晶体晶胞中所含有的铁原子数;先判断δ、α两种晶胞中铁原子的配位数,再计算其比值.
(2)同一周期元素的第一电离能随着原子序数的增大而增大,但第五主族元素的第一电离能大于第六主族元素的;根据每个N原子含有的σ 键个数与孤电子对数之和判断其杂化方式;配位键由提供孤电子对的原子指向提供空轨道的原子;
(3)由等电子体定义可知CO的一种常见等电子体为氮气,CO为极性分子熔点高;断裂配位键后,配体变为CO,中心原子结合成金属晶体;
(4)利用均摊法计算γ晶体晶胞中所含有的铁原子数;先判断δ、α两种晶胞中铁原子的配位数,再计算其比值.
解答:
解:(1)铁是26号元素,其原子核外有26个电子,根据构造原理其核外电子排布式为[Ar]3d64s2,则价层电子排布式为3d64s2,Fe属于第VIII族元素,在周期表中属于d区元素,故答案为:3d64s2;d;
(2)同一周期元素的第一电离能随着原子序数的增大而增大,但第五主族元素的第一电离能大于第六主族元素的,所以C、N、O三种元素的第一电离能由小到大的顺序是C、O、N;血红素中N原子有的含有3个σ 键和一个孤电子对,属于sp3杂化;有的含有3个σ 键,属于sp2 杂化方式;配位键由提供孤电子对的原子指向提供空轨道的原子,Fe2+的配位键为 ;
;
故答案为:C、O、N;sp2 sp3; ;
;
(3)CO的等电子体为氮气,氮气的结构式为N≡N,对于相对分子质量相等的分子晶体而言,极性分子沸点高,CO为极性分子,氮气为非极性分子,CO的沸点高;此配体的中心原子为金属原子,由于断裂的是中心原子和配体之间的配位键,所以断裂后配体形成CO,中心原子间形成金属键成为金属晶体;
故答案为:N≡N;CO;金属键;
(4)该晶胞中顶点上含有的原子数=
,面心上含有的原子数=
,所以一个晶胞中含有4个原子;δ、α两种晶胞中铁原子的配位数分别是8个和6个,所以δ、α两种晶胞中铁原子的配位数之比是4:3,故答案为:4;4:3.
(2)同一周期元素的第一电离能随着原子序数的增大而增大,但第五主族元素的第一电离能大于第六主族元素的,所以C、N、O三种元素的第一电离能由小到大的顺序是C、O、N;血红素中N原子有的含有3个σ 键和一个孤电子对,属于sp3杂化;有的含有3个σ 键,属于sp2 杂化方式;配位键由提供孤电子对的原子指向提供空轨道的原子,Fe2+的配位键为
 ;
;故答案为:C、O、N;sp2 sp3;
 ;
;(3)CO的等电子体为氮气,氮气的结构式为N≡N,对于相对分子质量相等的分子晶体而言,极性分子沸点高,CO为极性分子,氮气为非极性分子,CO的沸点高;此配体的中心原子为金属原子,由于断裂的是中心原子和配体之间的配位键,所以断裂后配体形成CO,中心原子间形成金属键成为金属晶体;
故答案为:N≡N;CO;金属键;
(4)该晶胞中顶点上含有的原子数=
| 1 |
| 8 |
| 1 |
| 2 |
点评:本题涉及的基态电子排布式、第一电离能的比较、配位键、晶胞的计算等,题目涉及的知识点较多,侧重于基础知识的应用的考查,难度中等,注意会运用均摊法计算晶胞中含有的原子个数,明确同一周期中元素的第一电离能的反常现象是解(2)题的关键.

练习册系列答案
相关题目
下列各装置中,能构成原电池的是( )
A、 |
B、 |
C、 |
D、 |
控制二氧化碳气体排放,“低碳生活”成为新的时尚潮流.下列不属于“低碳生活”方式的是( )
| A、多用电子邮件、MSN、QQ等即时通讯工具,少用传真打印机 |
| B、尽量使用太阳能等代替化石燃料 |
| C、大力开发和应用氢能源,有利于实现“低碳经济” |
| D、提倡塑料袋的无偿使用 |
日常生活中,常涉及到化学知识.下列说法正确的是( )
| A、营养补品吃得越多越好 |
| B、矿泉水中不含任何化学物质 |
| C、虽然药物能治病,但大部分药物都有不良反应 |
| D、食品添加剂的作用仅仅是为了好看 |
把一定量铁粉放入氯化铁溶液中,完全反应后,得到溶液中Fe2+和Fe3+的浓度恰好相等.则已反应的Fe3+和未反应的Fe3+的物质的量之比为( )
| A、1:1 | B、1:2 |
| C、2:3 | D、3:2 |
 磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在.它的单质和化合物在工农业生产中有着重要的作用.
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在.它的单质和化合物在工农业生产中有着重要的作用.