题目内容
A与B反应生成C,假定反应由A、B开始,它们的起始浓度均为2mol/L.反应进行2min后A的浓度为1.8mol/L,B的浓度为1.6mol/L,C的浓度为0.6mol/L.
(1)2min内反应的平均速率为:v(A)= ,v(B)= v (C )=
(2)三者数值之间的关系是:v(A)= v(B)= v(C)
(1)2min内反应的平均速率为:v(A)=
(2)三者数值之间的关系是:v(A)=
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:(1)根据v=
进行计算;
(2)根据(1)的数据进行分析判断.
| △c |
| t |
(2)根据(1)的数据进行分析判断.
解答:
解:(1)v(A)=
=0.1mol?L-1?min-1;
v(B)=
=0.2mol?L-1?min-1;
v(C )=
=0.3mol?L-1?min-1;
故答案为:0.1mol?L-1?min-1;0.2mol?L-1?min-1;0.3mol?L-1?min-1;
(2)v(A):v(B):v(C)=0.1mol?L-1?min-1:0.2mol?L-1?min-1:0.3mol?L-1?min-1=1:2:3,
故v(A)=
v(B)=
v(C),
故答案为:
;
.
| 2mol/L-1.8mol/L |
| 2min |
v(B)=
| 2mol/L-1.6mol/L |
| 2min |
v(C )=
| 0.6mol/L |
| 2min |
故答案为:0.1mol?L-1?min-1;0.2mol?L-1?min-1;0.3mol?L-1?min-1;
(2)v(A):v(B):v(C)=0.1mol?L-1?min-1:0.2mol?L-1?min-1:0.3mol?L-1?min-1=1:2:3,
故v(A)=
| 1 |
| 2 |
| 1 |
| 3 |
故答案为:
| 1 |
| 2 |
| 1 |
| 3 |
点评:本题考查化学反应速率的相关计算,把握化学反应速率的定义和化学反应速率之比等化学计量数之比为解答的关键,难度不大.

练习册系列答案
相关题目
A、B两容器分别贮有CH4和H2,若它们所含氢原子个数相等,则两容器的气体的质量比是( )
| A、1:2 | B、2:1 |
| C、4:1 | D、1:4 |
下列物质一般不参加复分解反应的是( )
| A、CuCl2 |
| B、KNO3 |
| C、Fe2O3 |
| D、H2SO4 |
能正确表示下列反应的离子方程式的是( )
| A、Cu溶于稀HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O |
| B、NaHCO3溶液中加入稀盐酸:CO32-+2H+═CO2↑+H2O |
| C、AlCl3溶液中加入过量稀氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
下列物质性质的变化规律与分子间作用力有关的是( )
| A、H2S、HCl的热稳定性依次增强 |
| B、金刚石的熔沸点高于晶体硅 |
| C、NaF、NaCl、NaBr、NaI的熔点依次降低 |
| D、CH4、SiH4、GeH4、SnH4的沸点逐渐升高 |
日常生活中常用到“加碘食盐”“含氟牙膏”等商品,这里的碘和氟应理解为( )
| A、单质 | B、分子 | C、元素 | D、氧化物 |
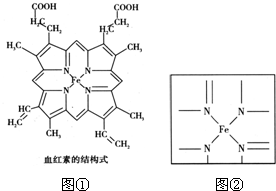

 ④CH3COONH4 ⑤NH4HCO3
④CH3COONH4 ⑤NH4HCO3 >HCO3-.常温下,物质的量浓度相同的①、②、③溶液pH由大到小顺序为(填序号)
>HCO3-.常温下,物质的量浓度相同的①、②、③溶液pH由大到小顺序为(填序号)