题目内容
在一定条件下,在容积为2L的密闭容器中,将2mol L气体和3mol M气体相混合,发生如下反应:2L(g)+3M(g)?xQ(g)+3R(g)4s后该反应达平衡时,生成2.4mol R,并测得Q的反应速率为0.1mol/(L?s),下列有关叙述正确的是( )
| A、x值为2 |
| B、混合气体的密度变大 |
| C、L的转化率为80% |
| D、平衡时M的浓度为0.6mol/L |
考点:化学平衡的计算
专题:化学平衡专题
分析:A.根据n=cV计算生成Q的物质的量,结合R的物质的量,利用物质的量之比等于化学计量数之比计算x的值;
B.容器的容积不变,混合气体的质量不变,根据ρ=
判断;
C.根据计算参加反应L的物质的量,L的转化率=
×100%;
D.根据生成的R的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的M的物质的量,M的平衡浓度=
.
B.容器的容积不变,混合气体的质量不变,根据ρ=
| m |
| V |
C.根据计算参加反应L的物质的量,L的转化率=
| 消耗量 |
| 起始量 |
D.根据生成的R的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的M的物质的量,M的平衡浓度=
| 平衡时M的物质的量 |
| V |
解答:
解:A.平衡时生成的Q的物质的量为0.1mol/L?s×2L×4s=0.8mol,生成R为2.4mol,物质的量之比等于化学计量数之比,故0.8mol:2.4mol=x:3,解得x=1,故A错误;
B.反应体系中各组分都是气体,混合气体的质量不变,容器的容积恒定,根据ρ=
可知混合气体的密度不变,故B错误;
C.反应达到平衡时,生成2.4molR,由方程式可知,参加反应的L的物质的量为1.6mol,则L的转化率为
×100%=80%,故C正确,
D.反应达到平衡时,生成2.4molR,由方程式可知,参加反应的M的物质的量为2.4mol,故平衡时M的物质的量为3mol-2.4mol=0.6mol,M的平衡浓度为=
0.3mol/L,故D错误;
故选:C.
B.反应体系中各组分都是气体,混合气体的质量不变,容器的容积恒定,根据ρ=
| m |
| V |
C.反应达到平衡时,生成2.4molR,由方程式可知,参加反应的L的物质的量为1.6mol,则L的转化率为
| 1.6mol |
| 2mol |
D.反应达到平衡时,生成2.4molR,由方程式可知,参加反应的M的物质的量为2.4mol,故平衡时M的物质的量为3mol-2.4mol=0.6mol,M的平衡浓度为=
| 0.6mol |
| 2L |
故选:C.
点评:本题考查了化学平衡计算,反应速率,转化率的计算及应用,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式书写正确的是( )
| A、Na2CO3溶液呈碱性:CO32-+2H2O?H2CO3+2OH- |
| B、氢氧化铁与稀硫酸反应:Fe(OH)3+3H+═Fe3++3H2O |
| C、FeCl3溶液与Na2S溶液混合:2Fe3++3S2-+6H2O═2Fe(OH)3↓+3H2S↑ |
| D、碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
化合物( )是一种取代有机氯农药D.D.T的新型杀虫剂,它含有官能团共有( )
)是一种取代有机氯农药D.D.T的新型杀虫剂,它含有官能团共有( )
 )是一种取代有机氯农药D.D.T的新型杀虫剂,它含有官能团共有( )
)是一种取代有机氯农药D.D.T的新型杀虫剂,它含有官能团共有( )| A、5种 | B、4种 | C、3种 | D、2种 |
下列说法不正确的是( )
| A、葡萄糖不可能由纤维素制取 |
| B、葡萄糖在酒化酶作用下转化为乙醇和二氧化碳 |
| C、葡萄糖是人体能量的重要来源 |
| D、葡萄糖能与银氨溶液发生反应 |
根据元素周期律和物质结构的有关知识,以下有关排序错误的是( )
| A、离子半径:S2->Cl->Ca2+ |
| B、原子半径:Ca>S>Cl |
| C、酸性:HClO4<HBrO4<HIO4 |
| D、热稳定性:HCl>H2S>H2Se |
下列是卤素单质(F2、Cl2、Br2、I2)的沸点与相对分子质量的关系图,下列说法错误的是( )


| A、单质①是最活泼的非金属单质 |
| B、单质②能使品红溶液褪色 |
| C、单质③在常温下是液态 |
| D、单质的氧化性强弱顺序是④>③>②>① |
关于甲、乙装置的下列叙述中正确的是( )


| A、甲池中通甲烷的极是负极,溶液中Na+向Pt电极移动 | ||||
| B、C电极的电极反应为:O2+4e-+4H+═2H2O | ||||
C、乙池中的总反应为:Cu+H2SO4
| ||||
| D、反应过程中,甲、乙装置中溶液的pH都逐渐减小 |
设NA表示阿佛加德罗常数,下列说法正确的是( )
| A、33.6L(常温常压)氯气与2.7g铝充分反应,转移电子数为0.3NA |
| B、在标准状况下,22.4L CH2Cl2中含有的氢原子数为2NA |
| C、标准状况下,22.4L己烷含有的共价键数目为19NA |
| D、46gNO2气体在标准状况下的体积为22.4L |
下列关于苯酚的叙述不正确的是( )
| A、苯酚是一种弱酸,滴加指示剂变色 |
B、苯酚在水溶液中能按下式电离: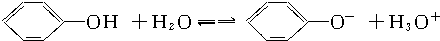 |
| C、苯酚钠在水溶液中几乎不能存在,会水解生成苯酚,所以苯酚钠溶液显碱性 |
| D、苯酚有腐蚀性,溅在皮肤上可用酒精冲洗 |