题目内容
在常温常压下,把30mL NO2和O2的混合气体通入倒置在水槽中充满水的量筒中,充分反应后,剩余5mL气体,试问在原混合气体中NO2和O2各为多少毫升?(请写出计算过程,只写结果不得分)
考点:有关混合物反应的计算
专题:计算题
分析:可能发生的反应为:4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,试管中O2和NO2气体按体积比1:4混合全部溶解,液体充满试管,假定全部为二氧化氮,剩余气体体积为
×30mL=10mL,实际是结果剩余5mL气体,小于10mL,则说明剩余气体为NO或氧气,
若为氧气,根据4NO2+O2+2H2O=4HNO3,求出参加此反应的O2,最后相加得到原来的氧气;
若为NO,先根据3NO2+H2O=2HNO3+2NO求出过量的NO2,然后根据4NO2+O2+2H2O=4HNO3求氧气体积,进而计算NO2的体积,据此解答.
| 1 |
| 3 |
若为氧气,根据4NO2+O2+2H2O=4HNO3,求出参加此反应的O2,最后相加得到原来的氧气;
若为NO,先根据3NO2+H2O=2HNO3+2NO求出过量的NO2,然后根据4NO2+O2+2H2O=4HNO3求氧气体积,进而计算NO2的体积,据此解答.
解答:
解:可能发生的反应为:4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,试管中O2和NO2气体按体积比1:4混合全部溶解,液体充满试管,假定全部为二氧化氮,剩余气体体积为
×30mL=10mL,实际是结果剩余5mL气体,小于10mL,则说明剩余气体为NO或氧气,
若为氧气,则参加反应的气体为30mL-5mL=25mL,根据4NO2+O2+2H2O=4HNO3,可知参加此反应的NO2的体积为25ml×
=20mL,参加反应的O2的体积为25mL-20mL=5mL,原混合气体中O2的体积为5mL+5mL=10mL;
若剩余气体为NO气体,根据3NO2+H2O=2HNO3+NO,可知过量的NO2为3×5mL=15mL,反应4NO2+O2+2H2O=4HNO3消耗的气体总体积为30mL-15mL=15mL,则反应消耗的氧气为15mL×
=3mL,则混合气体中NO2的体积=30mL-3mL=27mL,
答:原混合气体中V(NO2)=20mL、V(O2)=10mL或V(NO2)=27mL、V(O2)=3mL.
| 1 |
| 3 |
若为氧气,则参加反应的气体为30mL-5mL=25mL,根据4NO2+O2+2H2O=4HNO3,可知参加此反应的NO2的体积为25ml×
| 4 |
| 5 |
若剩余气体为NO气体,根据3NO2+H2O=2HNO3+NO,可知过量的NO2为3×5mL=15mL,反应4NO2+O2+2H2O=4HNO3消耗的气体总体积为30mL-15mL=15mL,则反应消耗的氧气为15mL×
| 1 |
| 5 |
答:原混合气体中V(NO2)=20mL、V(O2)=10mL或V(NO2)=27mL、V(O2)=3mL.
点评:本题考查了氮氧化物的性质、混合物有关计算,难度中等,关键是分析剩余气体的成分,再根据方程式计算.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
下列实验方案正确且能达到相应实验预期目的是( )
A、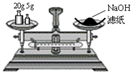 称量氢氧化钠固体 |
B、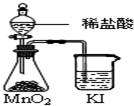 比较MnO2、Cl2、I2的氧化性 |
C、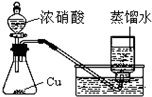 制取少量NO2 |
D、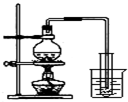 实验室制取蒸馏水 |
 (1)氢能作为一种新型能源具有燃烧热值高、资源丰富、燃烧产物无污染等优点.已知燃烧4g H2生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式
(1)氢能作为一种新型能源具有燃烧热值高、资源丰富、燃烧产物无污染等优点.已知燃烧4g H2生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式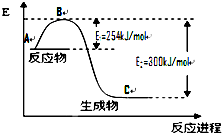 氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用.